Рандомизированное кооперированное исследование 3 фазы эффективности локальной терапии при первично выявленном метастатическом раке молочной железы
Обоснование исследования.
Рак молочной железы, по-прежнему, является одной из главных проблем клинической онкологии в связи с тем, что частота этого заболевания остается самой высокой среди злокачественных опухолей у женщин по всему миру. Несколько десятилетий назад диагноз диссеминированного РМЖ был практически приговором, однако достижения в лечении метастатического рака молочной железы позволили существенно повлиять на течение заболевания, продлить жизнь и улучшить качество жизни больных [1]. Существует множество публикаций, доказывающих целесообразность хирургического лечения определенной части больных метастатическим РМЖ. Более 25% больных после такой терапии живут 15 лет более [2,3,4]. На сегодняшний день нет четкого представления о значимости циторедуктивных операций при диссеминированном РМЖ. Наиболее дискутабельным вопросом являются критерии отбора больных для подобного лечения ; нет четкого представления, что играет детерминирующую роль - локализация метастазов, чувствительность к системному лечению, биологические характеристики опухоли или же комбинация этих факторов.
Существует несколько патофизиологических обоснований целесообразности удаления первичной опухоли при ПРРМЖ. Одно из них основано на наблюдениях об обратной корреляции выживаемости и количества метастазов, а также пораженных органов и систем [5-7]. Есть результаты целенаправленных иммунологических исследований об активации иммунной системы и улучшении соматического статуса после удаления первичной опухоли [8]. Установлено, что некоторые опухоли, в том числе РМЖ, способны индуцировать иммуносупрессию и за счет секреции цитокинов ускорять прогрессирование болезни. Выявлена прямая корреляция степени иммуносупрессии и количества циркулирующих микрометастазов опухоли [9].
Подтверждение эффективности удаления первичной опухоли при ПРРМЖ получено в клинической практике, однако лишь два исследования проведены проспективно с использованием метода рандомизации пациентов по виду лечения. В 2015 г. R.Badwe [10] опубликовал результаты исследования NCT00193778, проведенного в Мумбае в период 2005-2013 гг., в которое было включено 350 пациентов с ПРРМЖ. Всем пациентам в исследуемой группе up-front выполнялось оперативное лечение, за исключением случаев, когда опухоль была нерезектабельна. Таким пациентам на первом этапе проводилось 6-8 циклов химиотерапии, при регрессе опухоли больная включалась в исследование. При среднем периоде наблюдения 23 месяца не получено достоверных различий в показателях выживаемости в группах – средняя продолжительность жизни составила 19,2 мес. в группе оперированных больных и 20,5 мес. в контрольной группе (р=0,79). Авторы не рекомендуют удаление первичной опухоли у пациентов ПРРМЖ в рутинной практике, в том числе у больных, ответивших на проведенную front-line химиотерапию. Однако следует отметить, что продолжительность наблюдения за пациентами недостаточна для окончательных выводов.
Второе рандомизированное исследование проведено в Турции как многоцентровое, в период 2007-2013 гг. Включено 274 больных ПРРМЖ. Результаты исследования доложены в 2016 г. на ASCO [11]. Всем пациентам, вошедшим в исследуемую группу, первым этапом выполнялось удаление первичной опухоли. В этом исследовании зарегистрировано статистически достоверное увеличение медианы выживаемости с 37 до 46 мес. после оперативного лечения (р=0,01). Наиболее значимые улучшения показателей выживаемости после операции наблюдались у больных с ЭР+ и/или ПР+, HER2/neu - статусом опухоли, а также при метастатическом поражении только опорно-двигательного аппарата. По мнению авторов, именно такие пациенты являются наилучшими кандидатами для удаления первичной опухоли.
Все остальные известные исследования носят ретроспективный характер. Получено снижение относительного риска смерти (HR -hazardrisk) до 0,5-0,71 у оперированных больных [12-18].Наиболее крупные исследования проведены RapitiE. [13] и KhanS.A. [12]. Это крупные популяционные исследования, включившие большое число наблюдений. Однако такие исследования страдают от отсутствия детальной информации о каждом пациенте, позволяющей провести подробный анализ, например, информации о биологических характеристиках опухоли, виде операции и т.д. Тем не менее, обе работы подтвердили эффективность операции при ПРРМЖ. RapitiE. выделил основные факторы риска. Значимыми оказались: биологические характеристики опухоли, количество отдаленных метастазов и чистота краев резекции. При этом выполнение подмышечной лимфаденэктомии не влияло на течение заболевания. Полное удаление первичной опухоли с морфологическим подтверждением «чистых» краев операционной раны снижало относительный риск смерти на 40% по сравнению с больными, получившими только паллиативное лечение (р=0,049).
Подобные результаты получены в работе KhanS.A. Изучены результаты лечения 16023 больных РМЖ в период 1990-1993 гг., у которых в момент первичной постановки диагноза были обнаружены отдаленные метастазы. После удаления первичной опухоли относительный риск смерти снижался на 39%, 3-летняя выживаемость равнялась 35% у больных после хирургического лечения с «чистыми» краями резекции, 26% в группе с признаками опухолевого роста в краях резекции и 17,3% у неоперированных больных (р=0,0001). Также подтверждено отсутствие значимого влияния подмышечной лимфаденэктомии на продолжительность жизни.
В метаанализе, опубликованном Ruiterkamp в 2010 г. [19]HR составил 0,65 (95% ДИ 0,59-0,72).
E. Harris [20] в 2013 г. сообщил достаточно убедительные результаты мета- анализа, выполненного по материалам 10 публикаций, отобранных в MEDLINE. Обобщены результаты лечения 28693 больных ПРРМЖ, 52,8% из которых подверглись удалению первичной опухоли. Отмечено статистически достоверное увеличение 3-летней выживаемости в исследуемой группе (40% против 22%, р<0,01). При подгрупповом анализе наилучшие результаты после оперативного лечения наблюдались при меньшем размере первичной опухоли, менее значимых сопутствующих заболеваниях, одиночных очагах метастического поражения. Зависимости эффекта лечения от локализации метастазов, биологических характеристик опухоли (степени гистологической злокачественности, экспрессии стероидных гормонов) выявлено не было.
Последний мета-анализ провел в 2016 г. H.Headon [21] . Из 1628 публикаций были отобраны 16, соответствующих всем критериям анализа. Обобщенный HR составил 0,63 (95% ДИ 0,58-0,7, р=0,0001), таким образом относительный риск смерти у оперированных пациентов статистически достоверно снижается на 37%.
В различных исследованиях предпринимались попытки путем одно- и многофакторного анализа выделить наиболее значимые факторы, которые можно было бы использовать для отбора пациентов для хирургического лечения. Babiera[22] по результатам мультифакторного анализа сообщил о значимости единственного метастатического очага и отсутствии экспрессии Her2/neu. По данным Blanchard[16] независимыми факторами прогноза являются количество метастатических очагов и рецепторный статус опухоли. В этих исследованиях, а также в исследовании Gnerlich[15] локализация метастазов не имела принципиального значения. Напротив, Neuman [23] сообщил о высокой эффективноcти оперативного лечения только в группе больных с изолированными костными метастазами. Недавнее проспективное исследование Soran[11], проведенное в Турции, подтвердило эти данные. Информация, которую мы имеет сегодня, подтверждает тот факт, что эффект оперативного лечения непостоянен, и продолжаются попытки выделить наиболее значимые предиктивные факторы, с помощью которых можно было бы избирательно подходить к решению о необходимости выполнении операции.
В 2016г. опубликованы результаты крупного кооперированного исследования, проведенного в РФ [24]. Проанализированы результаты лечения 608 больных ПРРМЖ в период с 1990 по 2015 гг. по данным 5 лечебных учреждений - НИИ онкологии им. Н.Н. Петрова и СЗГМУ им. И.И. Мечникова (191 больная), НИОИ им. Герцена (176 больных), РОНЦ им. Блохина (197 больных) и Ростовского научно-исследовательского онкологического института (44 больных). Исследуемая и контрольные группы формировались ретроспективно. В исследуемую группу включались больные ПРРМЖ, которым было выполнено удаление первичной опухоли и проводилась системная противоопухолевая терапия. В контрольной группе больным проводилась только системная противоопухолевая терапия. Группы формировались «методом пар», то есть каждой пациентке из исследуемой группы подбиралась пациентка со схожими прогностическими характеристиками из контрольной группы. Средний период наблюдения составил 56 мес. (наименьший – 34 мес. в НИОИ им. Герцена и наболее продолжительный в НИИ онкологии им. Н.Н. Петрова и СЗГМУ им. И.И. Мечникова – 118 мес.).
Наибольшие потери, связанные с гибелью больных от прогрессирования заболевания, наблюдались в течение первых трех лет наблюдения. Уже на первом году наблюдения зарегистрированы различия в показателях выживаемости между группами, с течением времени разрыв увеличивался. В группе, где было выполнено удаление первичной опухоли, 3-летний период пережили 65% больных, в группе контроля лишь 47%, 5-летняя выживаемость составила соответственно 45% и 21% (p<0,001). Медиана выживаемости в первой группе 35 мес., в контрольной 23 мес. (p<0,01). Прогрессирование через 3 года в исследуемой группе наблюдалось у 54% больных, в контрольной группе у 77% . Через 5 лет – соответственно у 71% и 90% больных (p<0,01). Среднее время до прогрессирования заболевания в исследуемой группе составило 12 месяцев, в контрольной 8 месяцев. (p<0,02).
Наиболее эффективным удаление первичной опухоли оказалось при локализации отдаленных метастазов в костях. При метастазах в кости 1, 3 и 5- летняя выживаемость в группе больных, подвергшихся мастэктомии (n=113), составила соответственно 99%, 71% и 62%. Медиана выживаемости 45.5 мес. В группе контроля (n=101) 1-летняя выживаемость 100%, 3-летняя - 44%, 5-летняя - 21%, медиана выживаемости - 33.5 мес. (р=0,001). Среднее время до прогрессирования в исследуемой группе составило 30 мес., в контрольной - 18 мес. (р=0,001). При локализации метастазов в мягких тканях, висцеральных органах, поражении нескольких органов и систем различия между группами были менее значимыми или отсутствовали.
Количество отдаленных метастазов также оказалось значимым прогностическим фактором. При одном или двух метастазах в единственном органе удаление первичной опухоли увеличивало медиану выживаемости с 26 до 39 мес. (р =0,001). Но при трех и более очагах разницы в выживаемости между группами не получено (р=0,07).
В подгрупповом анализе обнаружено значимое влияние на эффективность оперативного лечения ответа на предоперационную системную терапию. При наличии частичного или полного регресса в ответ на системное лечение 1 линии удаление первичной опухоли увеличивало 3-летнюю выживаемость до 77% по сравнению с 54% в контрольной группе, а 5-летнюю до 57% против 29% (p=0,0001). Медиана выживаемости при наличии ответа на системную терапию составила в исследуемой группе 43 мес., а в контрольной 26 мес. (р=0,0001). При отсутствии ответа на системное лечение различие в показателях выживаемости в группах статистически недостоверно (p=0,09). Медиана общей выживаемости составила 27 мес. против 21 мес.
Из биологических характеристик опухоли наиболее значимым фактором, определяющим высокую эффективность оперативного лечения, оказалась высокая экспрессия рецепторов стероидных гормонов. У больных с высоким уровнем экспрессии рецепторов эстрогенов и прогестерона удаление первичной опухоли увеличивало среднюю продолжительность жизни с 34 мес. до 49 мес.(р=0,005). В группе больных с низким уровнем экспрессии удаление первичной опухоли также несколько улучшает прогноз, но не столь значимо – средняя продолжительность жизни составила 33 мес. против 26 мес. в контрольной группе (р=0,001). При анализе влияния HER2-cтатуса, степени гистологической злокачественности опухоли, категорий T и N, молекулярного типа опухоли установлено, что различия между группами менее значимы или отсутствуют.
Определенный интерес представляют результаты анализа полноты резекции первичной опухоли. Оказалось, что лишь достижение «чистых» краев резекции позволяет улучшить прогноз больной. При «чистых» краях резекции медиана выживаемости составила 39 мес., при наличии опухолевых клеток в краях резекции и отсутствии информации о краях резекции 22 мес. и 29 мес. соответственно, примерно такой же показатель у неоперированных больных - 23 мес. (p=0,0000).
Результаты проведенного исследования по материалам 5 крупных онкологических центров по основным показателям совпадают с приведенными зарубежными работами. Очень важной частью исследования является оценка эффекта оперативного лечения в различных подгруппах. Установлено, что наиболее эффективно удаление первичной опухоли при метастатическом поражении костей, 1-2 метастазах в пределах одного органа, наличии ответа на системное лечение, высокой экспрессии ЭР/ПР, возможности достижения «чистых»краев резекции. При других параметрах эффект от операции менее значим или отсутствует.
Обобщая изложенное выше, следует заключить, что для внедрения хирургического метода у больных диссеминированным РМЖ требуется проведение подтверждающих рандомизированных исследований, которые, наконец, позволят получить результаты наивысшего доказательного уровня и определят показания к такому лечению.
В отношении эффективности локальных воздействий на отдаленные метастазы при РМЖ также накоплен большой массив ретроспективной информации, и такой подход получил достаточно широкое распространение, однако не является стандартным и не имеет в настоящее время убедительной доказательной базы. Известно, что больные с одиночными отдаленными метастазами, получающие агрессивное комбинированное лечение, демонстрируют на удивление высокие показатели выживаемости. Многие из них после такого лечения десятилетиями живут без признаков рецидива заболевания. Термин «олигометастатическая болезнь» был впервые предложен HellmannandWeichselbaum в 1995 г. [25]. Он подразумевал клинические случаи с низким метастатическим потенциалом, когда контроль над заболеванием достигается с помощью локальных методов терапии. Это, по мнению авторов, специфическое промежуточное состояние между локальной потенциально излечимой болезнью и некурабельным метастатическим состоянием. Эрадикация отдаленных единичных метастазов, которая может быть достигнута хирургически или с помощью стереотактической аблятивной радиотерапии (САРТ)-новой технологии использования высоких прецизионных доз, подведенных прицельно к очагу- согласно этой гипотезе, может привести к значительному увеличению выживаемости и даже к излечению. САРТ – относительно новый, эффективный, неинвазивный широко применяемый альтернативный метод, который особенно актуален при олигометастатических заболеваниях.
Положительный эффект локальных терапевтических методов доказан при многих опухолях. При саркоме Ewing дополнительная лучевая терапия на метастатические очаги, в том числе тотальное облучение легких увеличивает 5-летнюю выживаемость с 20% до 40% [26]. При колоректальном раке хирургическое лечение одиночных метастазов в печени и легких достоверно улучшило отдаленные результаты, 28% больных прожили более 5 лет [27,28]. Если раньше потенциальная курабельность определялась технической возможностью удаления опухоли, то с появлением новых методов локального воздействия, таких как стереотактическая радиотерапия, радиочастотная абляция, криотерапия, возможности значительно расширились и особенно актуальными стали вопросы отбора пациентов.
Эти биологические закономерности распространяются и на рак молочной железы. При этом необходимо сказать, что современные подходы к системному лечению, его индивидуализация существенно увеличили продолжительность жизни больных метастатическим РМЖ. Публикации по результатам длительного наблюдения в BritishColumbia (2150 больных) [29] и MDAndersonCenter (1581 случаев) [30] продемонстрировали среднюю продолжительность жизни около 22 мес., а у 16,6% больных с полным регрессом опухоли этот показатель увеличился до 41,8 мес. Существенное увеличение длительности жизни больных генерализованным РМЖ с помощью эффективного системного лечения делает вопросы локальной терапии особо актуальными.
Этот тезис подтверждают данные E.Barlett [31]. Он использовал базу данных NationalInpatientSample (США) для изучения частоты применения метастазэктомии при опухолях наиболее часто встречающихся локализаций – колоректальном раке, раке легкого, РМЖ и меланоме за период 2000-2011 гг. Именно в такой последовательности распределяется частота выполнения метастазэктомии в зависимости от локализации первичной опухоли. Частота метастазэктомии значительно возросла за указанный период при всех локализациях: в 6,8 раз при колоректальном раке, в 5,8 раз при раке легкого, в 5,5 раз при РМЖ и в 4 раза при меланоме.
Однако несмотря на отдельные обнадеживающие результаты уровень доказательности эффективности такого подхода до сих пор недостаточен и требует контролируемых исследований. С появлением САРТ появились дополнительные возможности и генерирована серия исследований эффективности локальной терапии при олигометастатическом раке. Одно из таких исследований – SABR-COMET- было начато в 2012 г. Это рандомизированное исследование 2 фазы, в котором сравнивались показатели выживаемости контрольной группы больных с олигометастазами в количестве не более 5 различных первичных опухолей и исследуемой группы, получавшей в дополнение к стандартному лечению САРТ. Результаты были опубликованы в 2019 г (32). В исследование было включено 99 больных, из них 2/3 вошло в исследуемую группу. Средний период наблюдения составил 25 мес. Средняя продолжительность жизни в исследуемой группе была значимо выше – 41 мес против 28 мес в контрольной группе (P=0.09)(при этом цифра в исследуемой группе не окончательна). Наблюдалось также удвоение периода без прогрессирования в группе САРТ – с 6 до 12 мес. (Р=0,012). Однако в исследуемой группе было зарегистрировано значительное увеличение нежелательных явлений 2 степени и выше (у 29% больных против 9%), кроме того, наблюдалось три летальных исхода, связанных с проводимым лечением, что заставляет задуматься об очень избирательном подходе к отбору пациентов. Авторы подчеркивают, что дизайн исследования предусматривал достаточно широкие границы альфа-ошибки и результаты очень приблизительные и требуют дальнейшего подтверждения в исследованиях 3 фазы. Еще один открытый вопрос относительно допустимого количества очагов поражения. Большинство больных в исследовании SABR-COMET имели 1-3 очага (94%), действительно ли такое количество является пороговым для применения локальных воздействий остается неясным. В настоящее время идет набор в следующее исследование SABR-COMET 10 (NCT03721341), в которое включаюся пациенты с количеством метастазов от 4 до 10 и результаты его ожидаются научной общественностью с большим интересом (33).
Опубликованы результаты еще двух исследований 2 фазы эффективности локальной терапии при олигометастатической болезни. Исследования Iyengaretal. (34 ) и Gomezetal. (35 ) оценивали эффект локальной терапии (хирургического метода, локальной лучевой терапии или САРТ) после системной терапии первой линии при немелкоклеточном раке легкого. В обоих исследованиях зарегистрировано существенное увеличение периода без прогрессирования. В промежуточной анализе Gomez это увеличение было настолько впечатляющим, что исследование было прекращено досрочно после включения 49 больных. Исследование ORIOLEtrial (NCT02680587), представленное в 2019 на ASRO, в которое вошли 54 больных с гормонозависимым раком предстательной железы, продемонстрировало 19% случаев прогрессирования заболевания в группе САРТ против 61% в контрольной группе наблюдения (Р=0,005) (36 нов). В этом исследовании замечено, что если хотя бы один метастатический очаг не подвергался локальной терапии,показатели выживаемости без прогрессирования были значительно хуже. Таким образом, сделан предварительный вывод о необходимости «тотальной консолидации», т.е. локального лечения всех визуализируемых метастатических очагов. Перечень продолжающихся в настоящее время исследований эффективности САРТ при олигометастатическом раке различного генеза приведен ниже.
В случае синхронной с первичной опухолью олигометастатической болезнью возникает вопрос – насколько агрессивно следует воздействовать на первичный очаг? В 2019 на ESMO были представлены результаты исследования 3 фазы терапии 126 больных олигометастатическим назофарингеальным раком. В контрольной группе проводилась только химиотерапия, в исследуемой группе после инициальной химиотерапии была проведена лучевая терапия в СОД 66-70 Гр на первичный очаг и олигометастазы (37). Исследование было досрочно прекращено после демонстрации в промежуточном анализе увеличения медианы выживаемости с 24,5 мес в контрольной группе до 40,2 мес в группе САРТ (Р=0,007). Еще одно рандомизированное исследование 3 фазы STAMPEDE (38) показало значительное увеличение выживаемости при олигометастатическом раке предстательной железы при дополнительной лучевой терапии первичной опухоли (HR 0.68, 95% CI: 0.52–0.90; P=0.007). Всегда ли надо стремиться проводить локальное лечение первичной опухоли и всех олигометастазов? На этот вопрос должны ответить проводящиеся рандомизированные исследования, включая настоящее.
Продолжающиеся рандомизированные исследования 3 фазы эффективности САРТ при олигометастатическом раке
| Название исследования | Популяция больных | Метод лечения | Настоящий статус |
| SABR-COMET 3 NCT03862911 (39 ) | Метастатичческий рак (1–3 метастаза) | Стандартная терапия vs стандарт+САРТ | Набор продолжается |
| SABR-COMET 10 NCT03721341 (33 ) | Метастатичческий рак (4-10 метастазов) | Стандартная терапия vsстандарт+САРТ | Набор продолжается |
| CORE NCT02759783 (40 ) | Рак простаты, молочной железы, немелкоклеточный рак легкого | Стандартная терапия vs стандарт+САРТ | открыто |
| NRG-BR002 NCT02364557 (41) | Олигометастатический рак молочной железы | Стандартная терапия vs стандарт+САРТ | Открыто |
| NCT02820194 (42) | Неоперабельные метастазы в печень колоректального рака | САРТ vs РЧА | Набор продолжается |
| STEREO-SEIN NCT02089100 (43) | Олигометастатический рак молочной железы | САРТ vs системное лечение первой линии | Набор продолжается |
| SARON NCT02417662 (44) | Олигометастатический немелкоклеточный рак легкого | Радикальная ЛТ (традиционная конвенционная ЛТ и САРТ) vs химиотерапия | Набор продолжается |
| Sindas NCT02893332 (45) | Стадия IVEGFR+ немелкоклеточный рак легкого non-smallcelllungcancer | TKIvs консолидиоующая САРТ на все очаги | Набор продолжается |
Проведение исследования.
Исследование международное многоцентровое под руководством Научного комитета РООМ. Исследование будет проводится с участием российских медицинских центров, а также зарубежных центров. Оценку соответствия центров возможности участия в исследовании, мониторинг и регистрацию серьезных побочных эффектов, сбор и анализ информации будет осуществлять Научный комитет РООМ.
Дизайн исследования.
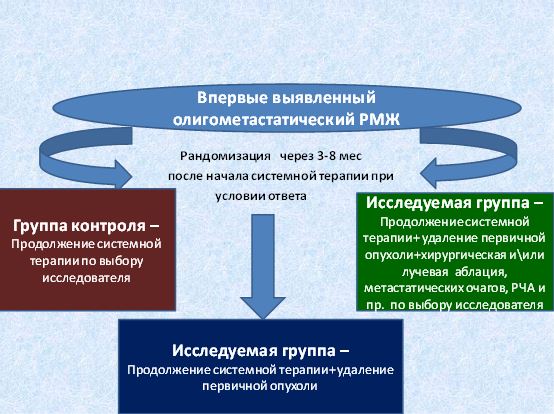
Планируется международное кооперированное многоцентровое исследование 3 фазы . Путем рандомизации пациенту будет назначен один из трех вариантов лечения: стандартное системное лечение (группа А) против стандартное системное лечение+ удаление первичной опухоли (группа В) против стандартное системное лечение+удаление первичной опухоли+ аблация хирургическая или лучевая всех визуализируемых отдаленных метастазов (группа С).
Наблюдение за пациентами будет осуществляться в следующем режиме: через 3 и 6 мес. выполнение КТ грудной и брюшной полости, при необходимости дополнительно КТ очагов поражения (группа А) и остеосцинтиграфия, оценка качества жизни пациентом по шкалам, далее каждые 6 мес до прогрессирования.
Цель исследования:
сравнить эффективность предлагаемых вариантов лечения путем сравнения выживаемости без прогрессирования (основной критерий) и качества жизни пациентов
Основной критерий оценки:
Выживаемость без прогрессирования –время от выявления отдаленных метастазов до
зафиксированного прогрессирования заболевания
Дополнительные критерии оценки:
Общая выживаемость – время от выявления отдаленных метастазов до смерти от любой причины
Качество жизни (оценка по шкале FACT-G)
Токсичность (оценка по шкале NCI-CTC) v.4
Критерии включения:
- Диссеминированный РМЖ – диагноз подтвержден морфологически .
- Возраст 18 лет и старше
- Подписанное информированное согласие
- Ожидаемая продолжительность жизни не менее 6 мес
- Проведено ИГХ исследование ЭР, ПР, Her2 в первичной опухоли и метастазе (необходимое условие –доступность материала первичной опухоли и метастаза для оценки в центральной лаборатории); при отсутствии информации об ИГХ метастаза включение больной должно обсуждаться с координатором исследования.
- Отсутствие Her2/neu гиперэкспрессии в первичной опухоли и метастазах
- ECOG 0-2
- Не более 3 метастазов в пределах одного органа или системы , подтвержденное визуальным методом . Допустимы олигометастазы в нескольких органах ,системах при условии возможности их хирургической или лучевой аблации, суммарно не более 5
- Возможность удаления первичной опухоли в пределах «чистых краев» одновременно (в период не более 4 недель) с локальным лечением метастазов.
- Стабилизация или регресс на фоне терапии 1 линии, проводимой не менее 3 и не более 8 мес до рандомизации и возможность продолжения терапии.
- Адекватное комплексное обследование не более чем за 30 дней до рандомизации: осмотр; КТ грудной, брюшной полости, таза; при возможности ПЭТ-КТ с последующими уточняющими методами визуализации , УЗИ при наличии мягкотканных метастазов, ОСГ, при наличии показаний (симптоматика или ТН/HER2+ РМЖ) МРТ головного мозга
Критерииисключения
- Прогрессирование на фоне системной терапии 1 линии
- Невозможность удаления первичной опухоли с достижением «чистых» краев резекции
- Невозможность локального лечения всех очагов метастазирования
- Гиперэкспрессия Her2/neu в первичной опухоли или метастазах
- Наличие в анамнезе инвазивной опухоли другой локализации при отсутствии возможности провести верификацию метастаза
- Наличие метастатического выпота в плевральной или брюшной полости, метастазы в ЦНС
- Тяжелые сопутствующие заболевания, препятствующие проведению запланированного лечения в полном объеме
- Беременность или лактация
Обследование и рандомизация.
Не более, чем за 30 дней перед включением в исследование пациент должен пройти полное обследование, включающее осмотр, КТ грудной, брюшной полости, таза; при возможности ПЭТ-КТ с последующими уточняющими методами визуализации , УЗИ при наличии мягкотканных метастазов, ОСГ, при необходимости КТ очагов, не вошедших в зону визуализации , при наличии показаний (симптоматика или ТН РМЖ) МРТ головного мозга. У пациентов с вертебральными или параспинальными метастазами требуется МРТ соответствующих зон.
Морфологическая верификация метастазов требуется, при невозможности необходимо обсуждение возможности включения в исследование с координатором.
После передачи всей информации о пациенте в течение 48 часов координатором исследования проводится процедура рандомизации методом блоков. Лечение соответственно группе рандомизации должно быть начато не позднее 14 календарных дней от даты рандомизации.
Планлечения.
Химиотерапия не разрешена менее, чем за 3 недели до первой дозы САРТ, во время САРТ и 2 недели после. Эндокринотерапия разрешена.
Группа А.
Стандартная терапия по выбору исследователя, во время проведения которой зафиксирован регресс или стабилизация, должна быть продолжена.
Группа В.
Удаление первичной опухоли должно быть выполнено не позднее, чем через 14 дней от даты рандомизации. Объем операции(мастэктомия или радикальная резекция) определяется хирургом с учетом необходимости достижения «чистых» краев резекции, что должно быть подтверждено в последующем морфологически. Подмышечная лимфаденэктомия при отсутствии признаков метастатического поражения не выполняется. При наличии признаков метастатического поражения (осмотр, УЗИ) производится одновременно с удалением первичной опухоли подмышечная лимфодиссекция в стандартном объеме. При наличии признаков опухоли по данным морфологического исследования операционного материала в крае резекции требуется реэксцизия до достижения «чистых» краев.
Системная противоопухолевая терапия проводится в стандартном режиме согласно лечебному плану до прогрессирования заболевания.
Группа С.
После удаления первичной опухоли хирургическая или лучевая абляция должна быть произведена как можно раньше, но не более, чем через 6 недель. При хирургической абляции морфологом должны быть оценены края резекции, при выявлении опухоли случай должен обсуждаться с координатором исследования.
Паллиативная лучевая терапия разрешена группе А и В – на костные очаги (8 Гр 1 фракция или 20 Гр за 5 фракций или 30 Гр за десять фракций).
САРТ проводится согласно современным стандартным протоколам для лечения метастазов в легкие, печень, позвоночник (46,47,48 ). Конкуррентная химиотерапия или таргетная терапия не разрешены за 4 недели до САРТ.Эндокринотерапия разрешена.
Дозы и фракционирование в зависимости от локализации очагов приведены ниже.
| Локализация очага | Описание | СОД (Gy) | Количество фракций | Доза на фракцию (Gy) | Частота |
| Легкое | Очаг 3 см или менее окруженный паренхимой легкого | 54 | 3 | 18 | Каждый второй день |
| Abutting chest wall or >3 cm | 55 | 5 | 11 | Каждый второй день | |
| В пределах 2 см от средостения или плечевого сплетения | 60 | 8* | 7.5 | Каждый второй день | |
| Кости | Любая кость кроме бедра | 35 Gy | 5 | 7 | ежедневно |
| Тело позвонка: дополнительная опция | 16-20 Gy OR | 1 | 16-20 | однократно | |
| 30 Gy | 3 | 10 | Каждый второй день | ||
| Печень | LRCP локализация: Dose is based on calculated normal tissue probability of <5% | Каждый второй день | |||
| Другие локализации | 45-60 | 3-8 | 7.5-15 | Каждый второй день | |
| Надпочечник | 60 Gy | 8 | 7.5 | Каждый второй день |
*If esophageal dose constraints cannot be met, 12 fractions should be used.
A Planning Target Volume (PTV) margin of 2-5 mm will be added depending on site of disease, immobilization, and institutional set-up accuracy: 2 mm margins may be used for spinal stereotactic treatments and 5 mm for other sites. Organs at risk visible in the planning CT scan will be contoured. Constraints for 1-, 3- and 5-fraction regimens are taken from Timmerman et al. 2008 [49 нов], whereas equivalent doses were calculated for other fractionation schemes.
For spinal lesions, a pre-treatment MRI is required to assess the extent of disease and position of the cord. This must be fused with the planning CT scan. A Planning Organ at Risk Volume (PRV) expansion of 2 mm will be added to the spinal cord, and dose constraints for the spinal cord apply to this PRV.
It is strongly recommended that dose constraints not be exceeded. If a dose constraint cannot be achieved due to overlap of the target with an organ at risk, the fractionation can be increased or the target coverage compromised in order to meet the constraint. It is strongly recommended that in cases where the target coverage is compromised in order to meet the constraint, the mean dose delivered to the GTV should be at least 80% of the nominal dose in Table Table1.1. All such cases of dose reduction or target coverage compromise must be approved by the local PI prior to treatment. For vertebral tumors, an adequate PRV of 2 mm must be added to the spinal cord, and the dose constraints apply to this PRV.
For lung tumors, doses are prescribed to approximately the 80% isodose line surrounding the PTV, resulting in a hotspot of 120-140%; the latter should fall within the GTV. 95% of the PTV should be covered by the prescription dose, and 99% of the PTV should be covered by 90% of the prescription dose.
For other tumor sites, doses are prescribed to approximately the 100% isodose level and 95% of the PTV should receive 95% of the prescription dose. Doses will be corrected for tissue inhomogeneity. Several non-overlapping 6/10 MV beams (on the order of 7-11 beams) or 1-2 VMAT arcs combined possibly with a few non-coplanar beams is recommended. Non-coplanar beams can be used to reduce 50% isodose volume for un-gated treatments. Coplanar beams are recommended for respiratory-gated treatment.
For lung or liver metastases, each metastasis can be treated with a separate isocenter if metastases are well-separated. Since most metastases are treated every other day (Table (Table1),1), when two metastases are treated, these can be done on alternating days to reduce the daily time required on the linear accelerator (e.g. Monday/Wed/Friday for one target, and Tues/Thurs/Mon for another). For brain metastases, all the metastases should be treated at the same time. For bone metastases, if multiple metastases can be imaged and localized at the same time, they can be treated at the same time, otherwise, they can be treated on alternate days.
The sequencing of tumor sites is at the discretion of individual physicians, but in general should begin with the brain, due to risks associated with progression, followed thereafter by liver, lung, and bonе
Режим наблюдения
| Перед лечением |
|
| ||
| Каждые 3 мес | Мес. 3, 6, 12, 18 и 24 | Каждые 6 мес. | ||
| Анамнез и осмотр | X | X | X | |
| Исследования перед включением в исследование(см. текст) | X | |||
| КТ грудной, брюшной полости, органов таза | X | X | ||
| ОСГ | X | X | ||
| Регистрация нежелательных явлений | X | X | ||
| FACT-G QOL заполнение | X | X | X | |
Обеспечение качества исследовании во всех центрах.
Все протоколы САРТ должны быть унифицированы во всех участвующих центрах. Каждый участвующий в проведении САРТ центр может выбрать, какие локализации будут подвергаться локальной терапии в этом центре.
Химиотерапия.
Не разрешается проведение химиотерапии за 4 недели до планируемой САРТ и 2 недели после ее завершения. Цитостатики, потенцирующие радиовоздействие (например, гемцитабин, адриамицин) не разрешены в течение 4 недель после завершения САРТ. Эндокринотерапияразрешена.
Follow-up
Первые 2 годапослерандомизациипациентынаблюдаютсякаждые 3 мес, далеекаждые 6 мес. Каждый визит регистрируются анамнестические данные и данные осмотра, нежелательные явления, заполняется пациентом шкала FACT-G.
КТ грудной, брюшной полости, органов таза, ОСГ выполняются через 3 мес после рандомизации, 6 мес, далее каждые 6 мес. Пациенты из группы САРТ при выявлении новых одиночных очагов направляются на САРТ или хирургическую абляцию. Любые дополнительные инструментальные или лабораторные обследования на усмотрение лечащего врача.
Оценка эффекта лечения.
Общая выживаемость измеряется как период о смерти от любой причины. Выживаемость без прогрессирования – время до прогрессирования или смерти, что случится первым. Оценка эффекта терапии по очагам будет производиться согласно международным критериям RECISTCommittee (http://ctep.info.nih.gov/guidelines/recist.html). Сумма наибольших диаметров всех таргетных очагов будет подсчитываться при включении в исследование и будет считаться референсным значением для оценки дальнейшего объективного ответа.
Лабораторная часть исследования.
Статистические предпосылки.
Sample size
This study will employ a randomized phase II design, to conduct a preliminary and non-definitive randomized comparison between the control and experimental arms. The study will aim to detect a signal in improved overall survival that would be used to design a phase III study to definitely compare survival outcomes between the two groups. The study will therefore be designed with alpha = 0.20 and beta = 0.20 (as recommended for phase II randomized studies [23]). It is estimated that the median survival of the control group after randomization in this study will be 9 months.
There will be a 1:2 randomization between Arm 1 and Arm 2. In order to detect a 6-month improvement in median survival from 9 months to 15 months with SABR, a total of 93 patients (31 in Arm 1 and 62 in Arm 2) will be needed. Assuming a 5% rate of loss to follow-up, a total of 99 patients will be accrued (33 in Arm 1 and 66 in Arm 2). The study projects accrual over 48 months with 12 months of additional follow-up. Accrual targets are as follows: 20 patients in year 1, and 25-30 patients in years 2, 3, and 4.
Обработка результатов исследования.
Анализ данных будет выполняться на популяции больных intention-to-treat
Первичный критерий
Выживаемость без прогрессирования будет подсчитываться по методу theKaplan-Meierи различие будет оцениваться с использованием log-ranktest. Подгрупповой анализ планируется для группы 1-3 метастаза и более. Регрессионный многофакторный анализ по Coxпланируется для определения независимых прогностических факторов.
Дополнительные критерии.
Общая выживаемость будет калькулироваться по методу Kaplan-Meier . Качество жизни каждые 6 мес будет измеряться по шкале FACT-G и сравниваться между группами с использованием критерия Стьюдента. Различия в количестве нежелательных явлений 2 степени и выше будут оцениваться с использованием критерия Фишера.
Data safety monitoring committee
The DSMC будетрассматриватьинформациювисследованииежегоднопосленачалаисследованияипослевключенияпервых 50 больныхсцельюанализанежелательныхявлений. Принаступлениинежелательногоявления 3-5 степени DSMCдолженрассмотретьслучайсцельюоценкивозможнойсвязислечением. При частоте нежелательных явлений >25% 3 степени или >5% 4 степени DSMC может рекомендовать прекращение исследования, изменения режима лечения или исключения некоторых локализаций очагов с наивысшей частотой осложнений. DSMCпланирует промежуточный анализ после включения первых 50 больных, для этого будут представлены данные для каждой группы по выживаемости без прогрессирования без указания варианта лечения («слепой» анализ). DSMCбудет рекомендовать прекращение исследования при выявлении различий между группами р<0,001 log-ranktest. Кроме того, если показатели выживаемости без прогрессирования в группах будут существенно отличаться от расчетных для samplesize, DSMCможет рекомендовать изменение количества пациентов в группах.
Аббревиатуры:
SABR, Stereotactic ablative radiotherapy; WBRT, Whole brain radiotherapy; RPA, Recursive partitioning analysis; PulMiCC, Pulmonary metastasectomy in colorectal cancer; FACT-G, Functional assessment of cancer therapy: general; NCI-CTC-AE, National Cancer Institute Common Terminology Criteria for Adverse Events; CT, Computed tomography; PET, Positron emission tomography; MRI, Magnetic resonance imaging; AST, Aspartate transaminase; ALT, Alanine transaminase; GGT, Gamma glutamyl transpeptidase; LRCP, London regional cancer program; VUmc, Vrije University medical center; GTV, Gross tumor volume; CTV, Clinical target volume; PTV, Planning target volume; PRV, Planning organ at risk volume; PI, Principal investigator; VMAT, Volumetric modulated arc therapy; QA, Quality assurance; CBCT, Cone Beam CT; ROI, Region of interest; IGTV, Internal GTV; RECIST, Response evaluation criteria in solid tumors; LD, Longest diameter; DSMC, Data safety monitoring committee; OS, Overall survival.
Литература
- Семиглазов В.Ф. Моисеенко В.М. Современное лекарственное лечение местнораспространенного и метастатического рака молочной железы. СПб-1997г. с 26-35.
- Khan SA. Does resection of an intact breast primary improve survival in metastatic breast cancer? Oncology. 2007;21(8):924–931.
- Sinha P, Clements VK, Miller S, Ostrand-Rosenberg S. Tumor immunity: a balancing act between T cell activation, macrophage activation and tumor-induced immune suppression. Cancer Immunol Immunother. 2005;54(11):1137–1142.
- Wood WC. Breast surgery in advanced breast cancer: local control in the presence of metastases. Breast. 2007;16(suppl 2):S63–S66.
- Nash C.H. III, Jones S.E., Moon T.E. et al. Prediction of outcome in metastatic breast cancer treated with adriamycin combination chemotherapy. Cancer 1980;46:2380−8.
- Vincent M.D., Powles T.J., Skeet R. et al. An analysis of possible prognostic features of long term and short term survivors of metastatic breast cancer. Eur J Cancer Clin Oncol 1986; 22: 1059-65.
- Hortobagyi G.N., Smith T.L., Legha S.S. et al. Multivariate analysis of prognostic factors in metastatic breast cancer. J Clin Oncol 1983;1:776−86.
- Caras I., Grigorescu A., Stavaru C. et al. Evidence for immune defects in breast and lung cancer patients. Cancer Immunol Immunother 2004;53:1146−52.
- Campbell M.J., Scott J., Maecker H.T. et al. Immune dysfunction and micrometastases in women with breast cancer. Breast Cancer Res Treat 2005;91:163−71.
- Badwe R., Hawaldar R., Nair N. et al. Locoregional treatment versus no treatment of the primary tumour in metastatic breast cancer: an open-label randomized controlled trial. Lancet oncol. 2015 Oct; 16(13): 1380-8.
- Soran A. et al. ASCO 2016. Abstract 1005.
- Khan SA, Stewart AK, Morrow M. Does aggressive local therapy improve survival in metastatic breast cancer? Surgery. 2002;132:620–627. doi: 10.1067/msy.2002.127544. [PubMed] [Cross Ref]
- Rapiti E, Verkooijen HM, Vlastos G. et al. Complete excision of primary breast tumor improves survival of patients with metastatic breast cancer at diagnosis. J Clin Oncol. 2006;24:2743–2749. doi: 10.1200/JCO.2005.04.2226. [PubMed] [Cross Ref]
- Fields RC, Donna BJ, Trinkaus K. et al. Surgical resection of the primary tumor is associated with increased long-term survival in patients with stage IV breast cancer after controlling for site of metastasis. Ann Surg Oncol. 2007;14(12):3345–3351. doi: 10.1245/s10434-007-9527-0. [PubMed][Cross Ref]
- Gnerlich J, Jeffe DB, Deshpande AD, Beers C, Zander C, Margenthaler JA. Surgical removal of the primary tumor increases overall survival in patients with metastatic breast cancer. Analysis of the 1988-2003 SEER data. Ann Surg Oncol. 2007;14(8):2187–2194. doi: 10.1245/s10434-007-9438-0.[PubMed] [Cross Ref]
- Blanchard DK, Shetty PB, Hilsenbeck SG, Elledge RM. Association of surgery with improved survival in stage IV breast cancer patients. Ann Surg. 2008;247(5):732–738. doi: 10.1097/SLA.0b013e3181656d32. [PubMed] [Cross Ref]
- Bafford AC, Burstein HJ, Barkley CR, Smith BL, Lipsitz S, Iglehart JD, Winer EP, Golshan M. Breast surgery in stage IV breast cancer: impact of staging and patient selection on overall survival. Breast Cancer Res Treat. 2009;115:7–12. doi: 10.1007/s10549-008-0101-7. [PubMed] [Cross Ref]
- Ruiterkamp J, Ernst MF, van de Poll-Franse LV, Bosscha K, Tjan-Heijnen VC, Voogd AC. Surgical resection of the primary tumour is associated with improved survival in patients with distant metastatic breast cancer at diagnosis. Eur J Surg Oncol. 2009;35:1146–1151. doi: 10.1016/j.ejso.2009.03.012.[PubMed] [Cross Ref]
- Ruiterkamp J, Voogd AC, Bosscha K, Tjan-Heijnen VCG, Ernst MF. Impact of breast surgery on survival in patients with distant metastases at initial presentation. A systematic review of the literature. Breast Cancer Res Treat. 2010;120(1):9–16. doi: 10.1007/s10549-009-0670-0. [PubMed] [Cross Ref]
- Harris E., Barry M., Kell MR. Meta-analysis to determine if surgical resection of the primary tumour in the setting of stage IY breast cancer impacts on survival. Ann Surg Oncol. 2013 Sep; 20(9):2828-34.
- Headon H, Wazir U, Kasem A et al. Surgical treatment of the primay tumor improves the overall survival in patients with metastatic breast cancer: A systematic review and meta-analysis. Mol Clin Oncol 2016; 4(5):863-7.
- Babiera GV, Rao R, Feng L, et al. Effect of primary tumor extirpation in breast cancer patients who present with stage IV disease and an intact primary tumor. Ann Surg Oncol. 2006;13(6):776–782.
- Neuman HB, Morrogh M, Gonen M et al. Stage IY breast cancer in the era of targeted therapy. Cancer 2010; 116:1226-33.
- Божок А.А., Топузов Э.Э., Зикиряходжаев А.Д., Сухотько А.С., Хайленко В.А., Шатова Ю.С., Климов Н.А., Палтуев Р.М. Оценка результатов НИР РООМ «Возможности хирургического лечения больных раком молочной железы IV стадии».Опухоли женской репродуктивной системы. 2016;12(4):17-24. DOI:10.17650/1994-4098-2016-12-4-17-24
- Hellman S, Weichselbaum RR. Oligometastases. J Clin Oncol 1995: 13:8-10.
- Paulussen M, Ahrens S, Craft AW et al. Ewing s tumors with primary lung metastases: survival analysis of 114 Cooperative Ewing s Sarcoma Studies patients. J Clin oncol 1998; 16:3044-52.
- Tomlinson JS, jarnagin WR, DeMatteo RP et al. Actual 10-year survival after resection of colorectal liver metastases defines cure. J Cin Oncol 2007; 25: 4575-80.
- Nordlinger B, Guiguet M, Vaillant JC et al. Surgical resection of colorectal carcinoma metastases to the liver. A prognostic scoring system to improve case selection, based on 1568 patients. Cancer 1996; 77:1254-62.
- Chia SK, Speers CH, D'yachkova Y, et al.: The impact of new chemotherapeutic and hormone agents on survival in a population-based cohort of women with metastatic breast cancer. Cancer 2007;110: 973-9.
- Rahman ZU, Frye DK, Smith TL, et al.: Results and long term follow-up for 1581 patients with metastatic carcinoma treated with standard dose doxorubicin-containing chemotherapy. Cancer 1999;85: 104-11.
- Barlett EK, Simmons KD, Wachtel H et al. The rise in metastasectomy across cancer types over the past decade. Cancer 2015; 121(5):747-57.
- Palma DA, Olson R, Harrow Set al. Stereotactic ablative radiotherapy versus standard of care palliative treatment in patients with oligometastatic cancers (SABR-COMET): a randomised, phase 2, open-label trial. Lancet 2019; 393(10185):2051-2058. doi: 10.1016/S0140-6736(18)32487-5.
- David P, Amsterdam University Medical Centre VS, British Columbia Cancer - Centre for the N, et al. Stereotactic Ablative Radiotherapy for Comprehensive Treatment of 4-10 Oligometastatic Tumors. 2019. Available online: https://ClinicalTrials.gov/show/NCT03721341.
- Iyengar P, Wardak Z, Gerber DE, et al. Consolidative Radiotherapy for Limited Metastatic Non-Small-Cell Lung Cancer: A Phase 2 Randomized Clinical Trial.JAMA Oncol 2018;4:e173501. 10.1001/jamaoncol.2017.3501 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Gomez DR, Tang C, Zhang J, et al. Local Consolidative Therapy Vs. Maintenance Therapy or Observation for Patients With Oligometastatic Non-Small-Cell Lung Cancer: Long-Term Results of a Multi-Institutional, Phase II, Randomized Study.J Clin Oncol 2019;37:1558-65. 10.1200/JCO.19.00201 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Phillips R, Lim SJ, Shi WY, et al. Primary Outcomes of a Phase II Randomized Trial of Observation Versus Stereotactic Ablative RadiatIon for OLigometastatic Prostate CancEr (ORIOLE). Int J Radiat Oncol Biol Phys 2019;105:681 10.1016/j.ijrobp.2019.08.031 [CrossRef] [Google Scholar]
- Chen M, You R, You-Ping L, et al. 1108O Chemotherapy plus local-regional radiotherapy versus chemotherapy alone in primary metastatic nasopharyngeal carcinoma: A randomized, open-label, phase III trial. Ann Oncol 2019;30. doi: .10.1093/annonc/mdz252 [CrossRef] [Google Scholar]
- Parker CC, James ND, Brawley CD, et al. Radiotherapy to the primary tumour for newly diagnosed, metastatic prostate cancer (STAMPEDE): a randomised controlled phase 3 trial.Lancet 2018;392:2353-66. 10.1016/S0140-6736(18)32486-3 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- British Columbia Cancer A, London Regional Cancer Program C, Beatson Institute for Cancer Research S, et al. Stereotactic Ablative Radiotherapy for Comprehensive Treatment of Oligometastatic (1-3 Metastases) Cancer. 2019. Available online: https://ClinicalTrials.gov/show/NCT03862911
- Royal Marsden NHSFT, Institute of Cancer Research UK, National Health Service UK. Conventional Care Versus Radioablation (Stereotactic Body Radiotherapy) for Extracranial Oligometastases. 2016. Available online: https://ClinicalTrials.gov/show/NCT02759783
- Oncology NRG, National Cancer I. Standard of Care Therapy With or Without Stereotactic Radiosurgery and/or Surgery in Treating Patients With Limited Metastatic Breast Cancer. 2015. Available online: https://ClinicalTrials.gov/show/NCT02364557
- Istituto Clinico H. A Trial on SBRT Versus MWA for Inoperable Colorectal Liver Metastases (CLM). 2016. Available online: https://ClinicalTrials.gov/show/NCT02820194
- Gustave Roussy CCGP. Trial of Superiority of Stereotactic Body Radiation Therapy in Patients With Breast Cancer. 2014. Available online: https://ClinicalTrials.gov/show/NCT02089100
- University College L, Cancer Research UK. Stereotactic Ablative Radiotherapy for Oligometastatic Non-small Cell Lung Cancer. 2015. Available online: https://ClinicalTrials.gov/show/NCT02417662
- Sichuan Provincial People's H. Stereotactic Body Radiation Therapy (SBRT) in Newly Diagnosed Advanced Staged Lung Adenocarcinoma (Sindas). 2016. Available online: https://ClinicalTrials.gov/show/NCT02893332
- Hurkmans CW, Cuijpers JP, Lagerwaard FJ, Widder J, van der Heide UA, Schuring D, Senan S. Recommendations for implementing stereotactic radiotherapy in peripheral stage IA non-small cell lung cancer: report from the Quality Assurance Working Party of the randomised phase III ROSEL study. Radiat Oncol. 2009;4:1. doi: 10.1186/1748-717X-4-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Lock M, Gaede S, Sinclair K, Fisher B, Perera F, Ahmad B, Sexton T, Rodrigues G, D'Souza D, Wong E. Phase I Study of Image-Guided and Radiobiologically-Guided Stereotactic Body Radiotherapy for Hepatic Lesions. Canadian Association of Radiation Oncologists Annual Meeting Abstract. 2010;38:2010. [Google Scholar]
- Kuijper IT, Dahele M, Senan S, Verbakel WFAR. Volumetric modulated arc therapy versus conventional intensity modulated radiation therapy for stereotactic spine radiotherapy: A planning study and early clinical data. Radiother Oncol. 2010;94(2):224–228. doi: 10.1016/j.radonc.2009.12.027. [PubMed] [CrossRef] [Google Scholar]
- Timmerman RD. An Overview of Hypofractionation and Introduction to This Issue of Seminars in Radiation Oncology. Semin Radiat Oncol. 2008;18(4):215–222. doi: 10.1016/j.semradonc.2008.04.001. [PubMed] [CrossRef] [Google Scholar]