|
|
|
|
| РООМ разместил — Золотой стандарт диагностики и лечения РМЖ 2024 на сайте |
 |
| Предложения просьба высылать на корпоративную почту info@breastcancersociety.ru |
 |
Генеральному директору РООМ Палтуеву Руслану Маликовичу. |
| |
|
.
РООМ БЛАГОДАРИТ АВТОРОВ дополнений |
 |
Член РООМ Ирина Владимировна Колядина д.м.н., проф. кафедры онкологии ФГБОУ ДПО РМАНПО на базе НМИЦ онкологии им.Н.Н. Блохина Минздрава России |
|
|
Системное лечение МРМЖ с герминальной мутацией PALB2 или соматической мутацией BRCA1/2 Возможно обсудить назначение Олапариба в дозе 300 мг 2 раза в день у больных с метастатическим HR+ HER2-негативным или тройным негативным РМЖ с наличием герминальной мутации PALB2 или соматической мутации BRCA1/2 в качестве ≥ 2й линии лечения. Результаты КИ II фазы TBCRC 048 показали высокую эффективность монотерапии Олапарибом у больных с мРМЖ с наличием герминальной мутации PALB2 (уровень объективного ответа – 82%, медиана ВБП – 13,3 мес), а также у пациентов с наличием в опухоли соматической мутации генов BRCA1/2 (уровень объективного ответа – 50%, медиана ВБП – 6,3 мес). Возможно обсудить назначение Олапариба в дозе 300 мг 2 раза в день у больных с метастатическим HR+ HER2-негативным или тройным негативным РМЖ с наличием герминальной мутации PALB2 или соматической мутации BRCA1/2 в качестве ≥ 2й линии лечения. Результаты КИ II фазы TBCRC 048 показали высокую эффективность монотерапии Олапарибом у больных с мРМЖ с наличием герминальной мутации PALB2 (уровень объективного ответа – 82%, медиана ВБП – 13,3 мес), а также у пациентов с наличием в опухоли соматической мутации генов BRCA1/2 (уровень объективного ответа – 50%, медиана ВБП – 6,3 мес). Уровень убедительности рекомендаций С (уровень достоверности доказательств 3) Уровень убедительности рекомендаций С (уровень достоверности доказательств 3)
Tung, Nadine M et al. Journal of clinical oncology vol. 38,36 (2020): 4274-4282. doi:10.1200/JCO.20.02151 |
 |
Член РООМ Ирина Владимировна Колядина д.м.н., проф. кафедры онкологии ФГБОУ ДПО РМАНПО на базе НМИЦ онкологии им.Н.Н. Блохина Минздрава России |
|
|
У пременопаузальных больных с HR+HER2- мРМЖ с гормоночувствительным РМЖ (ER>50%) с агрессивным течением заболевания (включая висцеральный криз) альтернативной проведения химиотерапии может быть проведение комбинированной эндокринотерапии Рибоциклиб 600мг в день 3 недели прием, 1 неделя перерыв + ингибиторы ароматазы (анастрозол 1мг или летрозол 2,5мг), на фоне овариальной супрессии (гозерелин 3,6мг 1 раз в 28 дней). Результаты РКИ III фазы RIGHT Choice Trial показание значимое преимущество комбинированной эндокринотерапии Рибоциклиб + ИА с овариальной супрессией по сравнению с комбинированной химиотерапией в снижении риска прогрессирования на 46% и увеличении медианы ВБП 24 мес vs 12,3 мес. При этом, частота достижения объективного ответа и время до его наступления были сопоставимы при комбинированной ЭТ с Рибоциклибом и комбинированной химиотерапии. Уровень убедительности рекомендаций B (уровень достоверности доказательств 2) Результаты РКИ III фазы RIGHT Choice Trial показание значимое преимущество комбинированной эндокринотерапии Рибоциклиб + ИА с овариальной супрессией по сравнению с комбинированной химиотерапией в снижении риска прогрессирования на 46% и увеличении медианы ВБП 24 мес vs 12,3 мес. При этом, частота достижения объективного ответа и время до его наступления были сопоставимы при комбинированной ЭТ с Рибоциклибом и комбинированной химиотерапии. Уровень убедительности рекомендаций B (уровень достоверности доказательств 2)
Yen-Shen Lu. Primary results from the randomized Phase II RIGHT Choice trial of premenopausal patients with aggressive HR+/HER2− advanced breast cancer treated with ribociclib + endocrine therapy vs physician’s choice combination chemotherapy., SABCS 2022, Oral Presentation, Abstract #GS1-10 |
 |
Член РООМ Валерий Витальевич Родионов ФГБУ «НМИЦ АКУШЕРСТВА, ГИНЕКОЛОГИИ И ПЕРИНАТОЛОГИИ ИМЕНИ АКАДЕМИКА В.И. КУЛАКОВА» МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РФ |
|
|
Наследственный рак молочной железы (РМЖ) – хирургическое лечение. Для пациенток с впервые диагностированным наследственным РМЖ может быть предложена мастэктомия с сохранением сосково-ареолярного комплекса, в тех случаях, когда выполнение данного вида хирургического вмешательства возможно с учётом онкологических подходов Уровень убедительности рекомендаций В (уровень достоверности доказательств 3) Для пациенток с впервые диагностированным наследственным РМЖ может быть предложена мастэктомия с сохранением сосково-ареолярного комплекса, в тех случаях, когда выполнение данного вида хирургического вмешательства возможно с учётом онкологических подходов Уровень убедительности рекомендаций В (уровень достоверности доказательств 3)
[Manning A.T., Wood C., Eaton A., et al: Nipple-sparing mastectomy in patients with BRCA1/2 mutations and variants of uncertain significance. Br J Surg. 2015;102:1354-1359; Yao K., Liederbach E., Tang R., et al: Nipple-sparing mastectomy in BRCA1/2 mutation carriers: An interim analysis and review of the literature. Ann Surg Oncol. 2015;22:370-376; Tang N.M., Boughey J.C., Pierce L.J. et al: Management of Hereditary Breast Cancer: American Society of Clinical Oncology, American Society for Radiation Oncology, and Society of Surgical Oncology Guideline. J Clin Oncol. 2020;38(18): 2080-2106]. Пациентки с впервые диагностированным РМЖ при наличии BRCA1,2 – мутации и имеющие все условия для выполнения органосохранной операции (ОСО) не должны быть лишены этой возможности Пациентки с впервые диагностированным РМЖ при наличии BRCA1,2 – мутации и имеющие все условия для выполнения органосохранной операции (ОСО) не должны быть лишены этой возможности Уровень убедительности рекомендаций В (уровень достоверности доказательств 3) [Nilsson M.P., Hartman L., Kristoffersson U., et al: High risk of in-breast tumor recurrence after BRCA1/2-associated breast cancer. Breast Cancer Res Treat. 2014;147:571-578; Pierce L.J., Phillips K.A., Griffith K.A., et al: Local therapy in BRCA1 and BRCA2 mutation carriers with operable breast cancer: Comparison of breast conservation and mastectomy. Breast Cancer Res Treat. 2010;121:389-398; van den Broek A.J., Schmidt M.K., van’t Veer L.J., et al: Prognostic impact of breast-conserving therapy versus mastectomy of BRCA1/2 mutation carriers compared with noncarriers in a consecutive series of young breast cancer patients. Ann Surg. 2019;270:364-372; Tang N.M., Boughey J.C., Pierce L.J. et al: Management of Hereditary Breast Cancer: American Society of Clinical Oncology, American Society for Radiation Oncology, and Society of Surgical Oncology Guideline. J Clin Oncol. 2020;38(18): 2080-2106; Sessa C., Balmaña J., Bober S.L., Cardoso M.J., Colombo N., et al. Risk reduction and screening of cancer in hereditary breast-ovarian cancer syndromes: ESMO Clinical Practice Guideline. Annals of Oncology. 2023; 34(1): 33-47]. Уровень убедительности рекомендаций В (уровень достоверности доказательств 3) [Nilsson M.P., Hartman L., Kristoffersson U., et al: High risk of in-breast tumor recurrence after BRCA1/2-associated breast cancer. Breast Cancer Res Treat. 2014;147:571-578; Pierce L.J., Phillips K.A., Griffith K.A., et al: Local therapy in BRCA1 and BRCA2 mutation carriers with operable breast cancer: Comparison of breast conservation and mastectomy. Breast Cancer Res Treat. 2010;121:389-398; van den Broek A.J., Schmidt M.K., van’t Veer L.J., et al: Prognostic impact of breast-conserving therapy versus mastectomy of BRCA1/2 mutation carriers compared with noncarriers in a consecutive series of young breast cancer patients. Ann Surg. 2019;270:364-372; Tang N.M., Boughey J.C., Pierce L.J. et al: Management of Hereditary Breast Cancer: American Society of Clinical Oncology, American Society for Radiation Oncology, and Society of Surgical Oncology Guideline. J Clin Oncol. 2020;38(18): 2080-2106; Sessa C., Balmaña J., Bober S.L., Cardoso M.J., Colombo N., et al. Risk reduction and screening of cancer in hereditary breast-ovarian cancer syndromes: ESMO Clinical Practice Guideline. Annals of Oncology. 2023; 34(1): 33-47]. Для пациенток с впервые диагностированным РМЖ и мутацией генов умеренного риска, мутационный статус не должен влиять на решение о выборе метода хирургического лечения первичной опухоли или необходимости выполнения контрлатеральной риск-редуцирующей мастэктомии Уровень убедительности рекомендаций С (уровень достоверности доказательств 5) [Tang N.M., Boughey J.C., Pierce L.J. et al: Management of Hereditary Breast Cancer: American Society of Clinical Oncology, American Society for Radiation Oncology, and Society of Surgical Oncology Guideline. J Clin Oncol. 2020;38(18): 2080-2106]. Для пациенток с впервые диагностированным РМЖ и мутацией генов умеренного риска, мутационный статус не должен влиять на решение о выборе метода хирургического лечения первичной опухоли или необходимости выполнения контрлатеральной риск-редуцирующей мастэктомии Уровень убедительности рекомендаций С (уровень достоверности доказательств 5) [Tang N.M., Boughey J.C., Pierce L.J. et al: Management of Hereditary Breast Cancer: American Society of Clinical Oncology, American Society for Radiation Oncology, and Society of Surgical Oncology Guideline. J Clin Oncol. 2020;38(18): 2080-2106]. Пациенткам с впервые диагностированным РМЖ и мутацией генов умеренного риска, должно быть предложено выполнение органосохранных операций, в тех случаях, когда они показаны. Отсутствуют убедительные данные о случаях ипсилатерального РМЖ после ОСО среди данной категории пациенток Пациенткам с впервые диагностированным РМЖ и мутацией генов умеренного риска, должно быть предложено выполнение органосохранных операций, в тех случаях, когда они показаны. Отсутствуют убедительные данные о случаях ипсилатерального РМЖ после ОСО среди данной категории пациенток Уровень убедительности рекомендаций С (уровень достоверности доказательств 5) Уровень убедительности рекомендаций С (уровень достоверности доказательств 5) [Tang N.M., Boughey J.C., Pierce L.J. et al: Management of Hereditary Breast Cancer: American Society of Clinical Oncology, American Society for Radiation Oncology, and Society of Surgical Oncology Guideline. J Clin Oncol. 2020;38(18): 2080-2106]. Пациенткам РМЖ с мутацией генов BRCA1,2, PALB2, которым выполнена (или планируется) односторонняя лечебная мастэктомия должна быть предложена контрлатеральная риск-редуцирующая мастэктомия (КРРМЭ). [Tang N.M., Boughey J.C., Pierce L.J. et al: Management of Hereditary Breast Cancer: American Society of Clinical Oncology, American Society for Radiation Oncology, and Society of Surgical Oncology Guideline. J Clin Oncol. 2020;38(18): 2080-2106]. Пациенткам РМЖ с мутацией генов BRCA1,2, PALB2, которым выполнена (или планируется) односторонняя лечебная мастэктомия должна быть предложена контрлатеральная риск-редуцирующая мастэктомия (КРРМЭ). КРРМЭ ассоциирована со снижением риска контрлатерального РМЖ; однако нет убедительных данных, что данное хирургическое вмешательство улучшает выживаемость Уровень убедительности рекомендаций В (уровень достоверности доказательств 2) [van Sprundel T.C., Schmidt M.K., Rookus M.A., et al: Risk reduction of contralateral breast cancer and survival after contralateral prophylactic mastectomy in BRCA1 or BRCA2 mutation carriers. Br J Cancer. 2005;93:287-292; Klu´zniak W., Huzarski T., et al: Clinical outcomes in women with breast cancer and a PALB2 mutation: A prospective cohort analysis. Lancet Oncol. 2015;16:638-644; Carbine N.E., Lostumbo L., Wallace J., et al. Risk-reducing mastectomy for the prevention of primary breast cancer. Cochrane Database Syst Rev. 2018;4:CD002748]. КРРМЭ ассоциирована со снижением риска контрлатерального РМЖ; однако нет убедительных данных, что данное хирургическое вмешательство улучшает выживаемость Уровень убедительности рекомендаций В (уровень достоверности доказательств 2) [van Sprundel T.C., Schmidt M.K., Rookus M.A., et al: Risk reduction of contralateral breast cancer and survival after contralateral prophylactic mastectomy in BRCA1 or BRCA2 mutation carriers. Br J Cancer. 2005;93:287-292; Klu´zniak W., Huzarski T., et al: Clinical outcomes in women with breast cancer and a PALB2 mutation: A prospective cohort analysis. Lancet Oncol. 2015;16:638-644; Carbine N.E., Lostumbo L., Wallace J., et al. Risk-reducing mastectomy for the prevention of primary breast cancer. Cochrane Database Syst Rev. 2018;4:CD002748].
Комментарий: Для оценки риска контрлатерального РМЖ и роли КРРМЭ у носительниц мутации генов высокого риска должны учитываться следующие факторы: возраст пациентки на момент постановки диагноза, фамильная история РМЖ, общий прогноз, возможность тщательного наблюдения (МРТ), сопутствующие заболевания и ожидаемая продолжительность жизни [Soenderstrup I.M.H., Laenkholm A.V., Jensen M.B., et al: Clinical and molecular characterization of BRCA-associated breast cancer: Results from the DBCG. Acta Oncol.2018;57:95-101; van Sprundel T.C., Schmidt M.K., Rookus M.A., et al: Risk reduction of contralateral breast cancer and survival after contralateral prophylactic mastectomy in BRCA1 or BRCA2 mutation carriers. Br J Cancer.2005;93:287-292; Carbine N.E., Lostumbo L., Wallace J., et al. Risk-reducing mastectomy for the prevention of primary breast cancer. Cochrane Database Syst Rev. 2018;4:CD002748; Tang N.M., Boughey J.C., Pierce L.J. et al: Management of Hereditary Breast Cancer: American Society of Clinical Oncology, American Society for Radiation Oncology, and Society of Surgical Oncology Guideline. J Clin Oncol. 2020;38(18): 2080-2106]. КРРМЭ у носительниц мутации генов BRCA1,2 могут выполняться как в пре-, так и в постменопаузе, в то время как у носительниц мутации гена PALB2 подобные операции более предпочтительно выполнять в пременопаузе [Curigliano G., Burstein H.J., Gnant M., Loibl S., Cameron D., Regan M.M., Denkert C., Poortmans P., Weber W.P., Thürlimann B. St Gallen Consensus Conference Panelists 2023 Understanding breast cancer complexity to improve patient outcomes: The St Gallen International Consensus Conference for the Primary Therapy of Individuals with Early Breast Cancer 2023 Ann Oncol. 2023 Sep 6:S0923-7534(23)]. Пациенткам РМЖ с мутацией генов умеренного риска, которым выполнена (или планируется) односторонняя лечебная мастэктомия, решение относительно КРРМЭ не должно преимущественно основываться на мутационном статусе Уровень убедительности рекомендаций С (уровень достоверности доказательств 5) [Tang N.M., Boughey J.C., Pierce L.J. et al: Management of Hereditary Breast Cancer: American Society of Clinical Oncology, American Society for Radiation Oncology, and Society of Surgical Oncology Guideline. J Clin Oncol. 2020;38(18): 2080-2106] Пациенткам РМЖ с мутацией генов умеренного риска, которым выполнена (или планируется) односторонняя лечебная мастэктомия, решение относительно КРРМЭ не должно преимущественно основываться на мутационном статусе Уровень убедительности рекомендаций С (уровень достоверности доказательств 5) [Tang N.M., Boughey J.C., Pierce L.J. et al: Management of Hereditary Breast Cancer: American Society of Clinical Oncology, American Society for Radiation Oncology, and Society of Surgical Oncology Guideline. J Clin Oncol. 2020;38(18): 2080-2106] Комментарий: Дополнительные факторы, предсказывающие риск контрлатерального РМЖ, такие как возраст пациентки на момент постановки диагноза и фамильная история РМЖ, следует учитывать во всех случаях. Влияние КРРМЭ на снижение риска контрлатерального РМЖ зависит от конкретного гена. Данные о риске развития контрлатерального РМЖ у пациенток с мутацией генов умеренного риска ограничены, за исключением CHEK2 1100delC. Информация о риске развития контрлатерального РМЖ должна обсуждаться с пациенткой в контексте совместного принятия решений [Broeks A., de Witte L., Nooijen A., et al: Excess risk for contralateral breast cancer in CHEK2*1100delC germline mutation carriers. Breast Cancer Res Treat. 2004;83:91-93; Cybulski C., Fletcher O., Johnson N., Dos Santos Silva I., et al: Family history, genetic testing, and clinical risk prediction: Pooled analysis of CHEK2 1100delC in 1,828 bilateral breast cancers and 7,030 controls. Cancer Epidemiol Biomarkers Prev. 2009;18:230-234; Kriege M., Hollestelle A., Jager A., et al: Survival and contralateral breast cancer in CHEK2 1100delC breast cancer patients: Impact of adjuvant chemotherapy. Br J Cancer. 2014;111:1004-1013; Weischer M., Nordestgaard B.G., Pharoah P., et al: CHEK2*1100delC heterozygosity in women with breast cancer associated with early death, breast cancer specific death, and increased risk of a second breast cancer. J Clin Oncol.2012;30:4308-4316; Tang N.M., Boughey J.C., Pierce L.J. et al: Management of Hereditary Breast Cancer: American Society of Clinical Oncology, American Society for Radiation Oncology, and Society of Surgical Oncology Guideline. J Clin Oncol. 2020;38(18): 2080-2106]. Комментарий: Дополнительные факторы, предсказывающие риск контрлатерального РМЖ, такие как возраст пациентки на момент постановки диагноза и фамильная история РМЖ, следует учитывать во всех случаях. Влияние КРРМЭ на снижение риска контрлатерального РМЖ зависит от конкретного гена. Данные о риске развития контрлатерального РМЖ у пациенток с мутацией генов умеренного риска ограничены, за исключением CHEK2 1100delC. Информация о риске развития контрлатерального РМЖ должна обсуждаться с пациенткой в контексте совместного принятия решений [Broeks A., de Witte L., Nooijen A., et al: Excess risk for contralateral breast cancer in CHEK2*1100delC germline mutation carriers. Breast Cancer Res Treat. 2004;83:91-93; Cybulski C., Fletcher O., Johnson N., Dos Santos Silva I., et al: Family history, genetic testing, and clinical risk prediction: Pooled analysis of CHEK2 1100delC in 1,828 bilateral breast cancers and 7,030 controls. Cancer Epidemiol Biomarkers Prev. 2009;18:230-234; Kriege M., Hollestelle A., Jager A., et al: Survival and contralateral breast cancer in CHEK2 1100delC breast cancer patients: Impact of adjuvant chemotherapy. Br J Cancer. 2014;111:1004-1013; Weischer M., Nordestgaard B.G., Pharoah P., et al: CHEK2*1100delC heterozygosity in women with breast cancer associated with early death, breast cancer specific death, and increased risk of a second breast cancer. J Clin Oncol.2012;30:4308-4316; Tang N.M., Boughey J.C., Pierce L.J. et al: Management of Hereditary Breast Cancer: American Society of Clinical Oncology, American Society for Radiation Oncology, and Society of Surgical Oncology Guideline. J Clin Oncol. 2020;38(18): 2080-2106]. Для пациенток с наследственным РМЖ, которым после хирургического лечения (ОСО или мастэктомии) показана лучевая терапия, данный вид лечения не следует отменять из-за мутационного статуса, за исключением мутации гена TP53 Уровень убедительности рекомендаций В (уровень достоверности доказательств 3) [van den Broek A.J., Schmidt M.K., van ’t Veer L.J., et al: Prognostic impact of breast- conserving therapy versus mastectomy of BRCA1/2 mutation carriers compared with noncarriers in a consecutive series of young breast cancer patients. Ann Surg. 2019;270:364-372; Cao W., Xie Y., He Y., et al: Risk of ipsilateral breast tumor recurrence in primary invasive breast cancer following breast-conserving surgery with BRCA1 and BRCA2 mutation in China. Breast Cancer Res Treat. 2019;175:749-754; Park H., Choi D.H., Noh J.M., et al: Acute skin toxicity in Korean breast cancer patients carrying BRCA mutations. Int J Radiat Biol. 2014;90:90-94; Pierce L.J., Strawderman M., Narod S.A., et al: Effect of radiotherapy after breast-conserving treatment in women with breast cancer and germline BRCA1/2 mutations. J Clin Oncol. 2000;18:3360-3369; Shanley S., McReynolds K., Ardern-Jones A., et al: Late toxicity is not increased in BRCA1/BRCA2 mutation carriers undergoing breast radiotherapy in the United Kingdom. Clin Cancer Res. 2006;12:7025-7032; Heymann S., Delaloge S., Rahal A., et al: Radio-induced malignancies after breast cancer postoperative radiotherapy in patients with Li-Fraumeni syndrome. Radiat Oncol. 2010;5:104; Limacher J.M., Frebourg T., Natarajan-Ame S., et al: Two metachronous tumors in the radiotherapy fields of a patient with Li-Fraumeni syndrome. Int J Cancer. 2001;96:238-242; Salmon A, Amikam D, Sodha N, et al: Rapid development of post- radiotherapy sarcoma and breast cancer in a patient with a novel germline ‘de-novo’ TP53 mutation. Clin Oncol (R Coll Radiol). 2007;19:490-493; Tang N.M., Boughey J.C., Pierce L.J. et al: Management of Hereditary Breast Cancer: American Society of Clinical Oncology, American Society for Radiation Oncology, and Society of Surgical Oncology Guideline. J Clin Oncol. 2020;38(18): 2080-2106]. Для пациенток с наследственным РМЖ, которым после хирургического лечения (ОСО или мастэктомии) показана лучевая терапия, данный вид лечения не следует отменять из-за мутационного статуса, за исключением мутации гена TP53 Уровень убедительности рекомендаций В (уровень достоверности доказательств 3) [van den Broek A.J., Schmidt M.K., van ’t Veer L.J., et al: Prognostic impact of breast- conserving therapy versus mastectomy of BRCA1/2 mutation carriers compared with noncarriers in a consecutive series of young breast cancer patients. Ann Surg. 2019;270:364-372; Cao W., Xie Y., He Y., et al: Risk of ipsilateral breast tumor recurrence in primary invasive breast cancer following breast-conserving surgery with BRCA1 and BRCA2 mutation in China. Breast Cancer Res Treat. 2019;175:749-754; Park H., Choi D.H., Noh J.M., et al: Acute skin toxicity in Korean breast cancer patients carrying BRCA mutations. Int J Radiat Biol. 2014;90:90-94; Pierce L.J., Strawderman M., Narod S.A., et al: Effect of radiotherapy after breast-conserving treatment in women with breast cancer and germline BRCA1/2 mutations. J Clin Oncol. 2000;18:3360-3369; Shanley S., McReynolds K., Ardern-Jones A., et al: Late toxicity is not increased in BRCA1/BRCA2 mutation carriers undergoing breast radiotherapy in the United Kingdom. Clin Cancer Res. 2006;12:7025-7032; Heymann S., Delaloge S., Rahal A., et al: Radio-induced malignancies after breast cancer postoperative radiotherapy in patients with Li-Fraumeni syndrome. Radiat Oncol. 2010;5:104; Limacher J.M., Frebourg T., Natarajan-Ame S., et al: Two metachronous tumors in the radiotherapy fields of a patient with Li-Fraumeni syndrome. Int J Cancer. 2001;96:238-242; Salmon A, Amikam D, Sodha N, et al: Rapid development of post- radiotherapy sarcoma and breast cancer in a patient with a novel germline ‘de-novo’ TP53 mutation. Clin Oncol (R Coll Radiol). 2007;19:490-493; Tang N.M., Boughey J.C., Pierce L.J. et al: Management of Hereditary Breast Cancer: American Society of Clinical Oncology, American Society for Radiation Oncology, and Society of Surgical Oncology Guideline. J Clin Oncol. 2020;38(18): 2080-2106]. Комментарий: Имеющиеся результаты исследований не продемонстрировали увеличение частоты серьёзных лучевых осложнений (переломы рёбер, пульмониты, пневмофиброз, эпителииты, фиброз мягких тканей, кардиты, кардиофиброз), а также ипси- и контрлатерального РМЖ у пациенток с носительством мутации генов BRCA1,2 [van den Broek A.J., Schmidt M.K., van ’t Veer L.J., et al: Prognostic impact of breast-conserving therapy versus mastectomy of BRCA1/2 mutation carriers compared with noncarriers in a consecutive series of young breast cancer patients. Ann Surg. 2019;270:364-372; Park H., Choi D.H., Noh J.M., et al: Acute skin toxicity in Korean breast cancer patients carrying BRCA mutations. Int J Radiat Biol. 2014;90:90-94; Pierce L.J., Strawderman M., Narod S.A., et al: Effect of radiotherapy after breast-conserving treatment in women with breast cancer and germline BRCA1/2 mutations. J Clin Oncol. 2000;18:3360-3369; Shanley S., McReynolds K., Ardern- Jones A., et al: Late toxicity is not increased in BRCA1/BRCA2 mutation carriers undergoing breast radiotherapy in the United Kingdom. Clin Cancer Res. 2006;12:7025-7032]. Комментарий: Имеющиеся результаты исследований не продемонстрировали увеличение частоты серьёзных лучевых осложнений (переломы рёбер, пульмониты, пневмофиброз, эпителииты, фиброз мягких тканей, кардиты, кардиофиброз), а также ипси- и контрлатерального РМЖ у пациенток с носительством мутации генов BRCA1,2 [van den Broek A.J., Schmidt M.K., van ’t Veer L.J., et al: Prognostic impact of breast-conserving therapy versus mastectomy of BRCA1/2 mutation carriers compared with noncarriers in a consecutive series of young breast cancer patients. Ann Surg. 2019;270:364-372; Park H., Choi D.H., Noh J.M., et al: Acute skin toxicity in Korean breast cancer patients carrying BRCA mutations. Int J Radiat Biol. 2014;90:90-94; Pierce L.J., Strawderman M., Narod S.A., et al: Effect of radiotherapy after breast-conserving treatment in women with breast cancer and germline BRCA1/2 mutations. J Clin Oncol. 2000;18:3360-3369; Shanley S., McReynolds K., Ardern- Jones A., et al: Late toxicity is not increased in BRCA1/BRCA2 mutation carriers undergoing breast radiotherapy in the United Kingdom. Clin Cancer Res. 2006;12:7025-7032]. Одновременно отсутствуют убедительные данные о различиях в токсичности лучевой терапии между пациентками с носительством и без носительства АТМ-мутации. [Bremer M., Klöpper K., Yamini P., et al: Clinical radiosensitivity in breast cancer patients carrying pathogenic ATM gene mutations: No observation of increased radiation-induced acute or late effects. Radiother Oncol. 2003;69:155-160; Broeks A., Braaf L.M., Huseinovic A., et al: Identification of women with an increased risk of developing radiation-induced breast cancer: A case only study. Breast Cancer Res.2007;9:R26; Iannuzzi C.M., Atencio D.P., Green S., et al: ATM mutations in female breast cancer patients predict for an increase in radiation-induced late effects. Int J Radiat Oncol Biol Phys. 2002;52:606-613; Meyer A., John E., Dörk T, et al: Breast cancer in female carriers of ATM gene alterations: Outcome of adjuvant radiotherapy. Radiother Oncol. 2004;72:319-323; Su Y., Swift M. Outcomes of adjuvant radiation therapy for breast cancer in women with ataxia-telangiectasia mutations. JAMA.2001;286:2233-2234. Вместе с тем, имеются данные, свидетельствующие о том, что мутация гена TP53 значительно увеличивает риск ипси- и контрлатерального РМЖ, а также радиоиндуцированных сарком [Heymann S., Delaloge S., Rahal A., et al: Radio-induced malignancies after breast cancer postoperative radiotherapy in patients with Li-Fraumeni syndrome. Radiat Oncol. 2010;5:104]. Одновременно отсутствуют убедительные данные о различиях в токсичности лучевой терапии между пациентками с носительством и без носительства АТМ-мутации. [Bremer M., Klöpper K., Yamini P., et al: Clinical radiosensitivity in breast cancer patients carrying pathogenic ATM gene mutations: No observation of increased radiation-induced acute or late effects. Radiother Oncol. 2003;69:155-160; Broeks A., Braaf L.M., Huseinovic A., et al: Identification of women with an increased risk of developing radiation-induced breast cancer: A case only study. Breast Cancer Res.2007;9:R26; Iannuzzi C.M., Atencio D.P., Green S., et al: ATM mutations in female breast cancer patients predict for an increase in radiation-induced late effects. Int J Radiat Oncol Biol Phys. 2002;52:606-613; Meyer A., John E., Dörk T, et al: Breast cancer in female carriers of ATM gene alterations: Outcome of adjuvant radiotherapy. Radiother Oncol. 2004;72:319-323; Su Y., Swift M. Outcomes of adjuvant radiation therapy for breast cancer in women with ataxia-telangiectasia mutations. JAMA.2001;286:2233-2234. Вместе с тем, имеются данные, свидетельствующие о том, что мутация гена TP53 значительно увеличивает риск ипси- и контрлатерального РМЖ, а также радиоиндуцированных сарком [Heymann S., Delaloge S., Rahal A., et al: Radio-induced malignancies after breast cancer postoperative radiotherapy in patients with Li-Fraumeni syndrome. Radiat Oncol. 2010;5:104]. |
 |
Член Правления РООМ, проф. Семиглазов Владислав Владимирович ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России, Санкт-Петербург |
|
|
Системное лечение больных РМЖ с наличием остаточной опухоли после неоадъювантного лечения (дополнение)
Адъювантная терапия олапарибом после неоадьювантного лечения у больных высокого риска с наличием патогенных герминальных мутаций генов BRCA1/2 Рекомендуется рассмотреть назначение таблетированной формы олапариба в дозе 600 мг внутрь ежедневно в течение 1 года: − больным с тройным негативным фенотипом (отрицательные ER, PR и HER2), получившим неоадъювантную ХТ антрациклинами и родственными соединениями и таксанами с или без соединений платины в стандартном объеме при наличии инвазивной резидуальной опухоли, соответствующей ypT≥1b или ypN+ или RCB II–III. − больным с HR+HER2- негативным фенотипом при наличии инвазивной резидуальной опухоли. Параллельно с олапарибом возможно назначение гормонотерапии. В крупном КРИ III фазы OlympiA с включением 1836 больных с ранним РМЖ с выявленными патогенными мутациями генов BRCA1/2 и высоким риском рецидива (83 % больных в исследовании – пациентки с тройным негативным РМЖ; 17 % больных в исследовании – пациенты с HR+HER2- негативным РМЖ) показано, что терапия олапарибом в дозе 300 мг 2 раза в день в течение 1 года после полностью законченного локального и системного лечения (неоадъювантной и/или адъювантной ХТ) снижает риск инвазивного рецидива на 37 % и приводит к значимому увеличению показателей 4-летней выживаемости без инвазивного рецидива с 75,4 % (подгруппа контроля) до 82,7 % (подгруппа олапариба), значимо снижает риск отдаленного метастазирования на 32 % и приводит к значимому увеличению показателей 4-летней выживаемости без отдаленных метастазов с 86,4 % (подгруппа контроля) до 89,8 % (подгруппа олапариба), и снижает риск смерти на 39 % и приводит к значимому увеличению показателей 4-летней общей выживаемости с 79,1 % (подгруппа контроля) до 86,5 % (подгруппа олапариба), в связи с чем олапариб рекомендован при BRCA-ассоциированном РМЖ в адъювантном режиме в группах высокого риска [275]. В крупном КРИ III фазы OlympiA с включением 1836 больных с ранним РМЖ с выявленными патогенными мутациями генов BRCA1/2 и высоким риском рецидива (83 % больных в исследовании – пациентки с тройным негативным РМЖ; 17 % больных в исследовании – пациенты с HR+HER2- негативным РМЖ) показано, что терапия олапарибом в дозе 300 мг 2 раза в день в течение 1 года после полностью законченного локального и системного лечения (неоадъювантной и/или адъювантной ХТ) снижает риск инвазивного рецидива на 37 % и приводит к значимому увеличению показателей 4-летней выживаемости без инвазивного рецидива с 75,4 % (подгруппа контроля) до 82,7 % (подгруппа олапариба), значимо снижает риск отдаленного метастазирования на 32 % и приводит к значимому увеличению показателей 4-летней выживаемости без отдаленных метастазов с 86,4 % (подгруппа контроля) до 89,8 % (подгруппа олапариба), и снижает риск смерти на 39 % и приводит к значимому увеличению показателей 4-летней общей выживаемости с 79,1 % (подгруппа контроля) до 86,5 % (подгруппа олапариба), в связи с чем олапариб рекомендован при BRCA-ассоциированном РМЖ в адъювантном режиме в группах высокого риска [275]. Режим адъювантной терапии олапарибом: 300 мг 2 раза в день внутрь ежедневно в течение 1 года [275]. Режим адъювантной терапии олапарибом: 300 мг 2 раза в день внутрь ежедневно в течение 1 года [275]. Geyer CE Jr, Garber JE, Gelber RD, et al. Overall survival in the OlympiA phase III trial of adjuvant olaparib in patients with germline pathogenic variants in BRCA1/2 and high-risk, early breast cancer. Ann Oncol. 2022 Dec;33(12):1250-1268. doi: 10.1016/j.annonc.2022.09.159. Адъювантная терапия абемациклибом в сочетании с гормонотерапией после неоадьювантного лечения у больных не достигшим pCR в первичной опухоли и/или в лимфатических узлах. Geyer CE Jr, Garber JE, Gelber RD, et al. Overall survival in the OlympiA phase III trial of adjuvant olaparib in patients with germline pathogenic variants in BRCA1/2 and high-risk, early breast cancer. Ann Oncol. 2022 Dec;33(12):1250-1268. doi: 10.1016/j.annonc.2022.09.159. Адъювантная терапия абемациклибом в сочетании с гормонотерапией после неоадьювантного лечения у больных не достигшим pCR в первичной опухоли и/или в лимфатических узлах. Комбинированная эндокринотерапия рекомендована после полностью законченной неоадъювантной ХТ и локального лечения в следующем режиме: абемациклиб 300 мг/сут (по 150 мг 2 раза в день) в течение 2 лет + эндокринотерапия (ингибиторы ароматазы – анастрозол 1 мг, или летрозол 2,5 мг, или эксеместан 25 мг, либо тамоксифен 20 мг) в течение 5–10 лет. Комбинированная эндокринотерапия рекомендована после полностью законченной неоадъювантной ХТ и локального лечения в следующем режиме: абемациклиб 300 мг/сут (по 150 мг 2 раза в день) в течение 2 лет + эндокринотерапия (ингибиторы ароматазы – анастрозол 1 мг, или летрозол 2,5 мг, или эксеместан 25 мг, либо тамоксифен 20 мг) в течение 5–10 лет. В рамках рандомизированного исследования MonarchE выполнен анализ эффективности адъювантной терапии абемациклибом+ГТ в подгруппе больных, получавших неоадъювантное системное лечение при раннем ЭР+HER2-негативном РМЖ (антрациклин и токсан-содержащая терапия). Зарегистрировано снижение риска инвазивного рецидива и риска отдаленных метастазов на 39% в группе абемациклиб+ГТ по сравнению с одной ГТ. Абсолютное увеличение 2-х летней выживаемости без инвазивного рецидива и отдаленных метастазов составило 6.6% и 6.7%, соответственно (p2 см) и количества позитивных аксиллярных лимфатических узлов в операционном материале (>4 против 1-3). Риск рецидива достоверно возрастал при увеличении размеров резидуальной опухоли и количества позитивных лимфатических узлов. Однако на эффективность исследуемой комбинации это не повлияло. [271], [272], [273]. В рамках рандомизированного исследования MonarchE выполнен анализ эффективности адъювантной терапии абемациклибом+ГТ в подгруппе больных, получавших неоадъювантное системное лечение при раннем ЭР+HER2-негативном РМЖ (антрациклин и токсан-содержащая терапия). Зарегистрировано снижение риска инвазивного рецидива и риска отдаленных метастазов на 39% в группе абемациклиб+ГТ по сравнению с одной ГТ. Абсолютное увеличение 2-х летней выживаемости без инвазивного рецидива и отдаленных метастазов составило 6.6% и 6.7%, соответственно (p2 см) и количества позитивных аксиллярных лимфатических узлов в операционном материале (>4 против 1-3). Риск рецидива достоверно возрастал при увеличении размеров резидуальной опухоли и количества позитивных лимфатических узлов. Однако на эффективность исследуемой комбинации это не повлияло. [271], [272], [273]. Martin M, Hegg R, Kim SB, Schenker M, Grecea D, Garcia-Saenz JA, Papazisis K, Ouyang Q, Lacko A, Oksuzoglu B, Reeves J, Okera M, Testa L, Shimizu C, Denduluri N, Adamchuk H, Dakhil S, Wei R, Forrester T, Fernandez MM, Zimmermann A, Headley D, Johnston SRD. Treatment With Adjuvant Abemaciclib Plus Endocrine Therapy in Patients With High-risk Early Breast Cancer Who Received Neoadjuvant Chemotherapy: A Prespecified Analysis of the monarchE Randomized Clinical Trial. JAMA Oncol. 2022 Aug 1;8(8):1190- 1194 doi: 10.1001/jamaoncol.2022.1488. PMID: 35653145; PMCID: PMC9164117. Martin M, Hegg R, Kim SB, Schenker M, Grecea D, Garcia-Saenz JA, Papazisis K, Ouyang Q, Lacko A, Oksuzoglu B, Reeves J, Okera M, Testa L, Shimizu C, Denduluri N, Adamchuk H, Dakhil S, Wei R, Forrester T, Fernandez MM, Zimmermann A, Headley D, Johnston SRD. Treatment With Adjuvant Abemaciclib Plus Endocrine Therapy in Patients With High-risk Early Breast Cancer Who Received Neoadjuvant Chemotherapy: A Prespecified Analysis of the monarchE Randomized Clinical Trial. JAMA Oncol. 2022 Aug 1;8(8):1190- 1194 doi: 10.1001/jamaoncol.2022.1488. PMID: 35653145; PMCID: PMC9164117. |
 |
Член РООМ к.м.н. Влада Владимировна Кометова ФГБУ НМИЦ Акушерства гинекологии и перинатологии им. В.И. Кулакова |
|
|
Рекомендуется для определения суррогатного базальноподобного РМЖ.
Исследование маркеров cytokeratin 5/6, EGFR. https://aacrjournals.org/clincancerres/article/10/16/5367/96410/Immunohistochemical-and- Clinical-Characterization Immunohistochemical and Clinical Characterization of the Basal-Like Subtype of Invasive Breast Carcinoma Torsten O. Nielsen; ТНРМЖ является гетерогенным заболеванием. Каждый подтип имеет существенные различия клинико-патологических характеристик. ТНРМЖ является гетерогенным заболеванием. Каждый подтип имеет существенные различия клинико-патологических характеристик.
Lehmann BD, Pietenpol JA. Clinical implications of molecular heterogeneity in triple negative breast cancer. Breast 2015; 24: S36–S40. Burstein M.D. Tsimelzon A. Poage G.M. et al. Comprehensive genomic analysis identifies novel subtypes and targets of triple-negative breast cancer. Clin Cancer Res. 2015 Apr 1; 21: 1688-1698 Базальный подтип наиболее геномно нестабильным подтипом с высокой мутацией TP53 (92%) и делецией числа копий в генах, участвующих в механизме репарации ДНК (BRCA2, MDM2, PTEN, RB1 и TP53). Unravelling triple-negative breast cancer molecular heterogeneity using an integrative multiomic analysis. Bareche Y, Venet D, Ignatiadis M, Aftimos P, Piccart M, Rothe F, Sotiriou C.Ann Oncol. 2018 Apr 1;29(4):895-902. doi: 10.1093/annonc/mdy024. В ТНРМЖ преобладает базальноподобный подобный подтип - 86.1 % с биологической точки зрения его следует рассматривать как отдельный тип рака. Важно отметить, что различие между базальноподобным и небазальноподобным ТНРМЖ может предсказать выживаемость после (нео)адъювантной полихимиотерапии преимущество бевацизумаба в неоадъювантной терапии (CALGB40603) и преимущество доцетаксела по сравнению с карбоплатином при метастатическом лечении первой линии. заболевания (исследование ТNТ). В целом, эти данные свидетельствуют о том, что внутреннее молекулярное профилирование предоставляет клинически значимую информацию, выходящую за рамки существующих классификаций, основанных на патологии. Важно отметить, что различие между базальноподобным и небазальноподобным ТНРМЖ может предсказать выживаемость после (нео)адъювантной полихимиотерапии преимущество бевацизумаба в неоадъювантной терапии (CALGB40603) и преимущество доцетаксела по сравнению с карбоплатином при метастатическом лечении первой линии. заболевания (исследование ТNТ). В целом, эти данные свидетельствуют о том, что внутреннее молекулярное профилирование предоставляет клинически значимую информацию, выходящую за рамки существующих классификаций, основанных на патологии.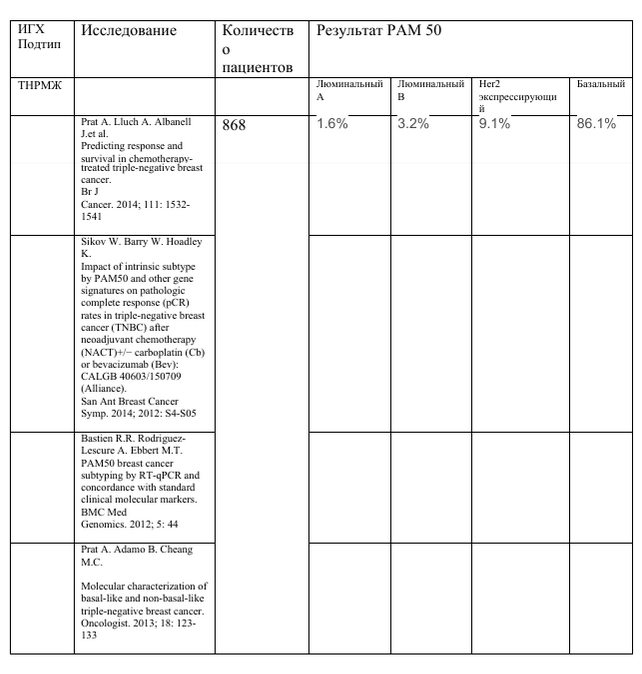 |
 |
Член РООМ Валерий Витальевич Родионов ФГБУ «НМИЦ АКУШЕРСТВА, ГИНЕКОЛОГИИ И ПЕРИНАТОЛОГИИ ИМЕНИ АКАДЕМИКА В.И. КУЛАКОВА» МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РФ |
|
|
| Наследственный рак молочной железы -Диагностика профилактика и лечение женщин с носительством патогенных мутаций |
Наследственный рак молочной железы (РМЖ) – злокачественное новообразование, диагностированное у пациентки, являющейся носителем мутации гена (генов), ответственного за развитие РМЖ. Почти 10% пациентов РМЖ имеют семейный фактор риска. При этом около 6% относятся к группе наследственного рака. Примерно половина (~3%) всех случаев наследственного РМЖ связана с генами высокого риска, такими как BRCA1, BRCA2, PALB2, CDH1, PTEN (Синдром Коудена), TP53 (Синдром Ли-Фраумени). Пожизненный риск РМЖ в этой группе 40-60% (таблица 1). Другая половина (~3%) связана с генами умеренного риска, такими как ATM, CHEK2, при этом пожизненный риск РМЖ обычно не превышает 25- 30%. У остальных 4% случаев фамильного РМЖ причинные факторы до конца неизвестны и могут быть обусловлены генетическими поломками, факторами внешней среды или их комбинацией. Почти 10% пациентов РМЖ имеют семейный фактор риска. При этом около 6% относятся к группе наследственного рака. Примерно половина (~3%) всех случаев наследственного РМЖ связана с генами высокого риска, такими как BRCA1, BRCA2, PALB2, CDH1, PTEN (Синдром Коудена), TP53 (Синдром Ли-Фраумени). Пожизненный риск РМЖ в этой группе 40-60% (таблица 1). Другая половина (~3%) связана с генами умеренного риска, такими как ATM, CHEK2, при этом пожизненный риск РМЖ обычно не превышает 25- 30%. У остальных 4% случаев фамильного РМЖ причинные факторы до конца неизвестны и могут быть обусловлены генетическими поломками, факторами внешней среды или их комбинацией. Таблица 1 Пожизненный риск РМЖ при наличии патогенных генов, ответственных за риск развития РМЖ [Sessa C., Balmaña J., Bober S.L., Cardoso M.J., Colombo N., et al. Risk reduction and screening of cancer in hereditary breast-ovarian cancer syndromes: ESMO Clinical Practice Guideline. Annals of Oncology. 2023; 34(1): 33-47] Таблица 1 Пожизненный риск РМЖ при наличии патогенных генов, ответственных за риск развития РМЖ [Sessa C., Balmaña J., Bober S.L., Cardoso M.J., Colombo N., et al. Risk reduction and screening of cancer in hereditary breast-ovarian cancer syndromes: ESMO Clinical Practice Guideline. Annals of Oncology. 2023; 34(1): 33-47] |
| Ген |
Риск РМЖ |
| ATM |
25-30% |
| BARD1 |
~ 20% |
| BRCA1 |
>60% |
| BRCA2 |
>60% |
| CDH1 |
40% |
| CHEK2 |
25-30% |
| PALB2 |
25-30% |
| PTEN |
40% |
| RAD51C |
20% |
| RAD51D |
10% |
| STK11 |
40% |
| TP53 |
40% |
|
Эпидемиологические исследования предполагают частоту носительства генов высокого риска (т.е. BRCA1, BRCA2, PALB2) у отдельных лиц с европеоидным/европейским происхождением в соотношении 1:150 [Rowley S.M., Mascarenhas L., Devereux L., et al. Population-based genetic testing of asymptomatic women for breast and ovarian cancer susceptibility. Genet Med. 2019;21(4):913-922; Manickam K., Buchanan A.H., Schwartz M.L.B., et al. Exome sequencing based screening for BRCA1/2 expected pathogenic variants among adult biobank participants. JAMA Netw Open. 2018;1(5):e182140; Maxwell K.N., Domchek S.M., Nathanson K.L., et al. Population frequency of germline BRCA1/2 mutations. J Clin Oncol. 2016;34(34):4183-4185.] Пациенткам с фамильной историей требуется проведение генетического тестирования на предмет выявления патогенных генов, ответственных за наследование РМЖ Пациенткам с фамильной историей требуется проведение генетического тестирования на предмет выявления патогенных генов, ответственных за наследование РМЖ Уровень убедительности рекомендаций А (уровень достоверности доказательств 2) Уровень убедительности рекомендаций А (уровень достоверности доказательств 2)
[Dorling L., Carvalho S., Allen J., et al. Breast cancer risk genes – association analysis in more than 113,000 patients. N Engl J Med. 2021;384(5):428-439; Hu C., Hart S.N., Gnanaolivu R., et al. A population-based study of genes previously implicated in breast cancer. N Engl J Med. 2021;384(5): 440-451; Buys S.S., Sandbach J.F., Gammon A., et al. A study of over 35,000 patients with breast cancer tested with a 25-gene panel of hereditary cancer genes. Cancer. 2017;123(10):1721-1730; Sessa C., Balmaña J., Bober S.L., Cardoso M.J., Colombo N., et al. Risk reduction and screening of cancer in hereditary breast-ovarian cancer syndromes: ESMO Clinical Practice Guideline. Annals of Oncology. 2023; 34(1): 33-47].
Оценка риска РМЖ должна проводиться в специализированных клиниках при наличии мультидисциплинарной команды, включающей специалистов лучевой диагностики, хирургов-онкологов, пластических хирургов, акушер-гинекологов, медицинских генетиков и психологов Уровень убедительности рекомендаций В (уровень достоверности доказательств 5) [Sessa C., Balmaña J., Bober S.L., Cardoso M.J., Colombo N., et al. Risk reduction and screening of cancer in hereditary breast-ovarian cancer syndromes: ESMO Clinical Practice Guideline. Annals of Oncology. 2023; 34(1): 33-47] Уровень убедительности рекомендаций В (уровень достоверности доказательств 5) [Sessa C., Balmaña J., Bober S.L., Cardoso M.J., Colombo N., et al. Risk reduction and screening of cancer in hereditary breast-ovarian cancer syndromes: ESMO Clinical Practice Guideline. Annals of Oncology. 2023; 34(1): 33-47] Женщины с носительством патогенных мутаций, увеличивающих риск развития РМЖ, должны проходить интенсивный скрининг, начиная с 30 лет, или на 5 лет раньше возраста наиболее молодой пациентки, заболевшей в семье РМЖ Уровень убедительности рекомендаций В (уровень достоверности доказательств 5) [Sessa C., Balmaña J., Bober S.L., Cardoso M.J., Colombo N., et al. Risk reduction and screening of cancer in hereditary breast-ovarian cancer syndromes: ESMO Clinical Practice Guideline. Annals of Oncology. 2023; 34(1): 33-47; Tang N.M., Boughey J.C., Pierce L.J. etal: Management of Hereditary Breast Cancer: American Society of Clinical Oncology, American Society for Radiation Oncology, and Society of Surgical Oncology Guideline. J Clin Oncol. 2020;38(18): 2080-2106] Женщины с носительством патогенных мутаций, увеличивающих риск развития РМЖ, должны проходить интенсивный скрининг, начиная с 30 лет, или на 5 лет раньше возраста наиболее молодой пациентки, заболевшей в семье РМЖ Уровень убедительности рекомендаций В (уровень достоверности доказательств 5) [Sessa C., Balmaña J., Bober S.L., Cardoso M.J., Colombo N., et al. Risk reduction and screening of cancer in hereditary breast-ovarian cancer syndromes: ESMO Clinical Practice Guideline. Annals of Oncology. 2023; 34(1): 33-47; Tang N.M., Boughey J.C., Pierce L.J. etal: Management of Hereditary Breast Cancer: American Society of Clinical Oncology, American Society for Radiation Oncology, and Society of Surgical Oncology Guideline. J Clin Oncol. 2020;38(18): 2080-2106] Комментарий: Носительницам мутации гена TP53 интенсивный скрининг рекомендуется начинать с 20 лет. У женщин с носительством мутаций генов ATM, BARD1, CHEK2, RAD51C или RAD51D должен быть оценен риск РМЖ для решения вопроса о необходимости прохождения интенсивного скрининга [Sessa C., Balmaña J., Bober S.L., Cardoso M.J., Colombo N., et al. Risk reduction and screening of cancer in hereditary breast- ovarian cancer syndromes: ESMO Clinical Practice Guideline. Annals of Oncology. 2023; 34(1): 33-47]. Комментарий: Носительницам мутации гена TP53 интенсивный скрининг рекомендуется начинать с 20 лет. У женщин с носительством мутаций генов ATM, BARD1, CHEK2, RAD51C или RAD51D должен быть оценен риск РМЖ для решения вопроса о необходимости прохождения интенсивного скрининга [Sessa C., Balmaña J., Bober S.L., Cardoso M.J., Colombo N., et al. Risk reduction and screening of cancer in hereditary breast- ovarian cancer syndromes: ESMO Clinical Practice Guideline. Annals of Oncology. 2023; 34(1): 33-47]. Интенсивный скрининг у женщин с носительством патогенных мутаций, увеличивающих риск развития РМЖ, должен включать ежегодные маммографию и МРТ Интенсивный скрининг у женщин с носительством патогенных мутаций, увеличивающих риск развития РМЖ, должен включать ежегодные маммографию и МРТ Уровень убедительности рекомендаций В (уровень достоверности доказательств 3) [Mann R.M., Kuhl C.K., Moy L. Contrast-enhanced MRI for breast cancer screening. J Magn Reson Imaging. 2019;50(2):377-390; Gao Y., Reig B., Heacock L., et al. Magnetic resonance imaging in screening of breast cancer. Radiol Clin North Am. 2021;59(1):85-98; Geuzinge H.A., Obdeijn I.M., Rutgers E.J.T., et al. Cost-effectiveness of breast cancer screening with magnetic resonance imaging for women at familial risk. JAMA Oncol. 2020;6(9):1381-1389. Sessa C., Balmaña J., Bober S.L., Cardoso M.J., Colombo N., et al. Risk reduction and screening of cancer in hereditary breast-ovarian cancer syndromes: ESMO Clinical Practice Guideline. Annals of Oncology. 2023; 34(1): 33-47; Tang N.M., Boughey J.C., Pierce L.J. etal: Management of Hereditary Breast Cancer: American Society of Clinical Oncology, American Society for Radiation Oncology, and Society of Surgical Oncology Guideline. J Clin Oncol. 2020;38(18): 2080-2106] Уровень убедительности рекомендаций В (уровень достоверности доказательств 3) [Mann R.M., Kuhl C.K., Moy L. Contrast-enhanced MRI for breast cancer screening. J Magn Reson Imaging. 2019;50(2):377-390; Gao Y., Reig B., Heacock L., et al. Magnetic resonance imaging in screening of breast cancer. Radiol Clin North Am. 2021;59(1):85-98; Geuzinge H.A., Obdeijn I.M., Rutgers E.J.T., et al. Cost-effectiveness of breast cancer screening with magnetic resonance imaging for women at familial risk. JAMA Oncol. 2020;6(9):1381-1389. Sessa C., Balmaña J., Bober S.L., Cardoso M.J., Colombo N., et al. Risk reduction and screening of cancer in hereditary breast-ovarian cancer syndromes: ESMO Clinical Practice Guideline. Annals of Oncology. 2023; 34(1): 33-47; Tang N.M., Boughey J.C., Pierce L.J. etal: Management of Hereditary Breast Cancer: American Society of Clinical Oncology, American Society for Radiation Oncology, and Society of Surgical Oncology Guideline. J Clin Oncol. 2020;38(18): 2080-2106] |
 |
Доктор медицинских наук, профессор Сазонов Сергей Владимирович ГАУЗ СО Институт медицинских клеточных технологий |
|
|
| Проведение генетического тестирования мутаций в генах BRCA1/2 |
Рекомендуется проведение генетического тестирования мутаций в генах BRCA1/2 методом ПЦР или NGS в лимфоцитах крови или в ткани опухоли из парафиновых блоков с последующей консультацией врача-генетика. Герминальные патогенные варианты в генах BRCA1, BRCA2 приводят к значительному увеличению риска развития рака молочной железы: уровень пенетрантности у носителей патогенных вариантов в данных генах находится в диапазоне от 41% до 90%. Показания для проведения исследований: Показания для проведения исследований:
1. РМЖ у женщин в возрасте меньше 45 лет;
2. РМЖ у женщин с установленным Тройным негативным подтипом (ИГХ);
3. РМЖ у женщин при отягощенном семейном анамнезе. Т.е. наличие у близких родственников 1-2 степени родства:
- РМЖ в возрасте ≤50 лет, рака яичников или маточных труб, рака поджелудочной железы, РМЖ у мужчины, метастатического рака предстательной железы);
- наличие герминальных мутаций BRCA1/2.
4. первично-множественный рак у женщин (синхронный или метахронный РМЖ, рак яичников или маточных труб, первичный рак брюшины, экзокринный рак поджелудочной железы в любом возрасте);
5. РМЖ у мужчин в любом возрасте.
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5). Рекомендуется пациенток, имеющих личный/наследственный анамнез, у которых методом ПЦР не выявлены частые наследственные мутации, а так же лиц неславянской этнической группы направлять на расширенное исследование герминальных и/или соматических мутаций с использованием высокопроизводительного секвенирования (NGS). Исследование включает 8 показателей и позволяет определить аллельные варианты: BRCA1 (мутации 185delAG, 4153delA, 5382insC, 3819delGTAAA, 3875delGTCT, 300T>G (Cys61Gly), 2080delA) и BRCA2 (мутация 6174delT). Рекомендуется пациенток, имеющих личный/наследственный анамнез, у которых методом ПЦР не выявлены частые наследственные мутации, а так же лиц неславянской этнической группы направлять на расширенное исследование герминальных и/или соматических мутаций с использованием высокопроизводительного секвенирования (NGS). Исследование включает 8 показателей и позволяет определить аллельные варианты: BRCA1 (мутации 185delAG, 4153delA, 5382insC, 3819delGTAAA, 3875delGTCT, 300T>G (Cys61Gly), 2080delA) и BRCA2 (мутация 6174delT). Помимо герминальных патогенных вариантов, мутации в генах BRCA1, BRCA2 могут обнаруживаться только в опухолевой ткани – соматические мутации. Выявление соматических мутаций не позволяет подтвердить наследственный характер опухоли, но является одним из показаний назначения PARP-ингибиторов (NCCN, 2021). При выявлении соматических мутаций в генах BRCA1, BRCA2 рекомендуется проведение исследования на наличие герминальных вариантов. Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5). Помимо герминальных патогенных вариантов, мутации в генах BRCA1, BRCA2 могут обнаруживаться только в опухолевой ткани – соматические мутации. Выявление соматических мутаций не позволяет подтвердить наследственный характер опухоли, но является одним из показаний назначения PARP-ингибиторов (NCCN, 2021). При выявлении соматических мутаций в генах BRCA1, BRCA2 рекомендуется проведение исследования на наличие герминальных вариантов. Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5). |
 |
Член РООМ Валерий Витальевич Родионов ФГБУ «НМИЦ АКУШЕРСТВА, ГИНЕКОЛОГИИ И ПЕРИНАТОЛОГИИ ИМЕНИ АКАДЕМИКА В.И. КУЛАКОВА» МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РФ |
|
|
| Алгоритм хирургического лечения пациенток ранним раком молочной при размерах опухоли ≤ 2 см |
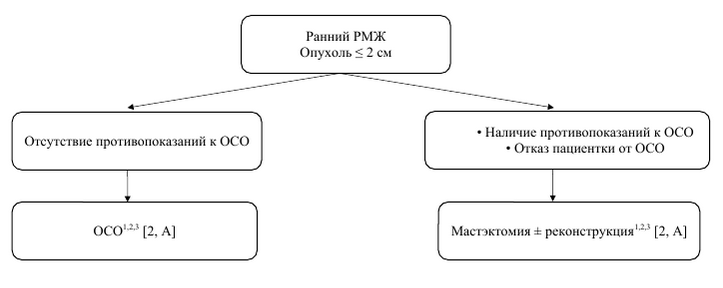 |
1Fisher B., Redmond C., Poisson R. et al. Eight-year results of randomized clinical trial comparing total mastectomy and lumpectomy with or without irradiation in treatment of breast cancer. N Engl J Med 1989;320:822-828. 2Veronesi U., Volterrani F., Luini A. et al. Breast conservation is a safe method in patients with small cancer of the breast. Long-term results of three randomized trials on 1,973 patients. Eur J Cancer 1995;31A:1547-1549. 3Litière S., Werutsky G., Fentiman I.S., etal. Breast conserving therapy versus mastectomy for stage I-II breast cancer: 20 year follow-up of the EORTC 10801 phase 3 randomised trial. Lancet Oncol. 2012 Apr;13(4):412-9.
Примечание: РМЖ – рак молочной железы; ОСО – органосохранная операция. |
| Алгоритм хирургического лечения пациенток ранним раком молочной при размерах опухоли > 2 см |
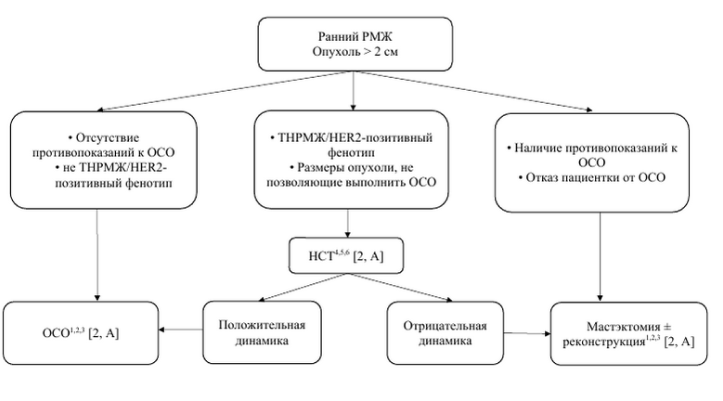 |
1Fisher B., Redmond C., Poisson R. et al. Eight-year results of randomized clinical trial comparing total mastectomy and lumpectomy with or without irradiation in treatment of breast cancer. N Engl J Med 1989;320:822-828. 2Veronesi U., Volterrani F., Luini A. et al. Breast conservation is a safe method in patients with small cancer of the breast. Long-term results of three randomized trials on 1,973 patients. Eur J Cancer 1995;31A:1547-1549. 3Litière S., Werutsky G., Fentiman I.S., etal. Breast conserving therapy versus mastectomy for stage I-II breast cancer: 20 year follow-up of the EORTC 10801 phase 3 randomised trial. Lancet Oncol 2012 Apr;13(4):412-9. 4Karakatsanis A., Tasoulis M.K., Wärnberg F., Nilsson G, MacNeill F. Meta-analysis of neoadjuvant therapy and its impact in facilitating breast conservation in operable breast cancer. Br J Surg 2018 Apr;105(5):469-481. 5Gianni L., Pienkowski T., Im Y.H. et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomized multicentre, open-label, phase 2 trial. Lancet Oncol 2012; 13(1):25–32. 6Semiglazov V.F., Semiglazov V.V., Dashyan G.A., Ziltsova E.K., et al. Phase 2 randomized trial of primary endocrine therapy versus chemotherapy in postmenopausal patients with estrogen receptor-positive breast cancer. Cancer 2007 Jul 15;110(2):244-54.
Примечание: РМЖ – рак молочной железы; ОСО – органосохранная операция; ТНРМЖ – трижды-негативный рак молочной железы; НСТ – неоадьювантная системная терапия. |
| Алгоритм аксиллярной хирургии при cN0 |
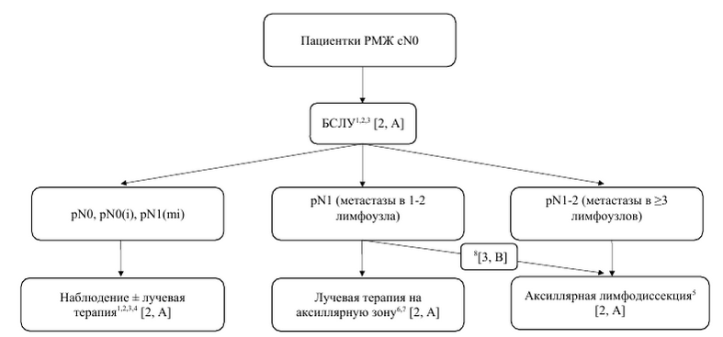 |
1Glechner A., Wöckel A., Gartlehner G., et al. Sentinel lymph node dissection only versus complete axillary lymph node dissection in early invasive breast cancer: a systematic review and meta-analysis. Eur J Cancer 2013 Mar;49(4):812-25. 2Krag D.N., Anderson S.J., Julian T.B., et al. Sentinel-lymph-node resection compared with conventional axillary-lymph-node dissection in clinically node-negative patients with breast cancer: overall survival findings from the NSABPB-32 randomised phase 3 trial. Lancet Oncol 2010;11(10):927–33. 3Veronesi U., Viale G., Paganelli G., et al. Sentinel lymph-node biopsy in breast cancer: ten-year results of a randomized controlled study. Ann Surg 2010;251(4):595–600. 4Galimberti V., Cole B.F., Viale G., et al. Axillary dissection versus no axillary dissection in patients with breast cancer and sentinel-node micrometastases (IBCSG 23-01): 10-year follow-up of a randomised, controlled phase 3 trial. Lancet Oncol 2018;19(10):1385–93. 5Giuliano A.E., Ballman K.V., McCall L., et al. Effect of axillary dissection vs no axillary dissection on 10-year overall survival among women with invasive breast cancer and sentinel node metastasis: the ACOSOG Z0011 (Alliance) randomized clinical trial. JAMA 2017;318:918–26. 6Donker M., van Tienhoven G., Straver M.E., et al. Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer (EORTC 10981-22023 AMAROS): a randomised, multicenter, open-label, phase 3 non-inferiority trial. Lancet Oncol 2014;15:1303–10. 7Sávolt Á., Péley G., Polgár C., et al. Eight-year follow up result of the OTOASOR trial: The Optimal Treatment Of the Axilla - Surgery Or Radiotherapy after positive sentinel lymph node biopsy in early-stage breast cancer: a randomized, single center, phase III, non-inferiority trial. Eur J Surg Oncol 2017;43(4):672-9. 8Dings P.J.M., Elferink M.A.G., Strobbe L.J.A., et al. The Prognostic Value of Lymph Node Ratio in Node-Positive Breast Cancer: A Dutch Nationwide Population-Based Study. Ann Surg Oncol 2013; 20:2607–2614.
Примечание: РМЖ – рак молочной железы; БСЛУ – биопсия сигнального лимфоузла. |
| Алгоритм аксиллярной хирургии при cN1 после неоадьювантной системной терапии |
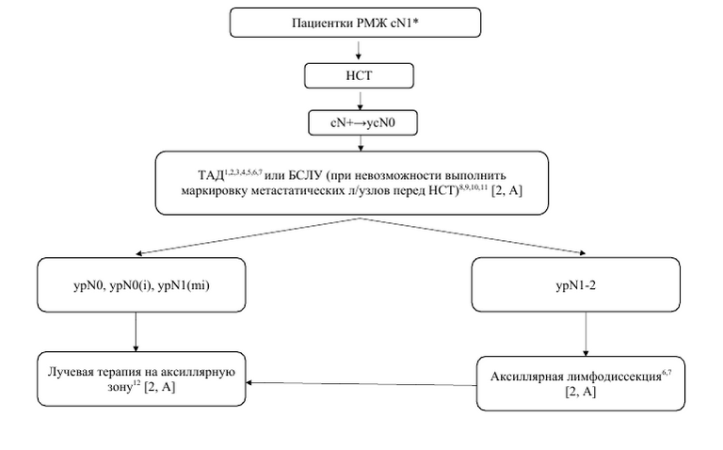 |
1Kuehn T., Bauerfeind I., Fehm T., et al. Sentinel-lymph-node biopsy in patients with breast cancer before and after neoadjuvant chemotherapy (SENTINA): A prospective, multicenter cohort study. Lancet Oncol 2013;14:609–18. 2Boughey J.C., Suman V.J., Mittendorf E.A., et al. Sentinel lymph node surgery after neoadjuvant chemotherapy in patients with node-positive breast cancer: TheACOSOG Z1071 (Alliance) clinical trial. JAMA 2013;310:1455–61. 3Tee S.R., Devane L.A., Evoy D., et al. Meta-analysis of sentinel lymph node biopsy after neoadjuvant chemotherapy in patients with initial biopsy-proven node-positive breast cancer. Br J Surg 2018;105:1541–52. 4Classe J.M., Loaec C., Gimbergues P., et al. Sentinel lymph node biopsy with- out axillary lymphadenectomy after neoadjuvant chemotherapy is accurate and safe for selected patients: the GANEA 2 study. Breast Cancer Res Treat 2018;173:343–52 . 5Galimberti V., Ribeiro Fontana S.K., Maisonneuve P., et al. Sentinel node biopsy after neoadjuvant treatment in breast cancer: five-year follow-up of patients with clinically node- negative or node-positive disease before treatment. Eur J Surg Oncol 2016;42:361–8. 6Simons J.M., Koppert L.B., Luiten E.J.T., et al. De-escalation of axillary surgery in breast cancer patients treated in the neoadjuvant setting: a Dutch population-based study. Breast Cancer Res Treat 2020;180:725–33. 7Simons J.M., van Nijnatten T.J.A., van der Pol C.C., et al. Diagnostic Accuracy of Different Surgical Procedures for Axillary Staging After Neoadjuvant Systemic Therapy in Node- positive Breast Cancer. A Systematic Review and Meta-analysis. Ann. Surg 2019; 269: 432–442. 8Galimberti V., Kahler Ribeiro Fontana S, Vicini E., Morigi C., et. al. “This house believes that: Sentinel node biopsy alone is better than TAD after NACT for cN+ patients”. The Breast. 2023;67:21-25. 9Banys-Paluchowski M; Del Rosario M, Perez C, Chavez Diaz M, Heidinger M et al. Oncological Outcomes Following Omission of Axillary Lymph Node Dissection in Node Positive Patients Downstaging To Node Negative with Neoadjuvant Chemotherapy: the OPBC-04/EUBREAST-06/OMA study. Cancer Res (2023) 83 (5_Supplement): GS4-02. 10Curigliano G., Burstein H.J., Gnant M., Loibl S., Cameron D., Regan M.M., Denkert C., Poortmans P., Weber W.P., Thürlimann B. St Gallen Consensus Conference Panelists 2023 Understanding breast cancer complexity to improve patient outcomes: The St Gallen International Consensus Conference for the Primary Therapy of Individuals with Early Breast Cancer 2023 Ann Oncol. 2023 Sep 6:S0923-7534(23). doi: 10.1016/j.annonc.2023.08.017. 11Barrio A.V., Montagna G., Mamtani A., et al. Nodal recurrence in patients with node-positive breast cancer treated with sentinel node biopsy alone after neoadjuvant chemotherapy e a rare event. JAMA Oncol. 2021;7(12):1851 12Mamounas E.P., White J.R., Bandos H., et al. NSABP B-51/RTOG 1304: randomized phase III clinical trial evaluating the role of postmastectomy chest wall and regional nodal XRT (CWRNRT) and post-lumpectomy RNRT in patients (pts) with documented positive axillary (Ax) nodes before neoadjuvant chemotherapy (NC) who convert to pathologically negative Ax nodes after NC. J Clin Oncol 2014;32(Suppl):TPS1141.
Примечание: РМЖ – рак молочной железы; НСТ – неоадьювантная системная терапия; ТАД – таргетная аксиллярная диссекция; БСЛУ – биопсия сигнального лимфоузла; * – пациенткам с воспалительной формой заболевания (Т4d) и/или N2-3 требуется выполнение аксиллярной лимфодиссекции вне зависимости от ответа на НСТ |
| Оценка краёв резекции |
| |
Отсутствие краски на опухоли |
Край резекции > 2 мм |
Нет необходимости оценивать край резекции |
| Инвазивный рак |
+ |
|
|
| Инвазивный рак + DCIS |
+ |
|
|
| DCIS |
|
+ |
|
| LCIS (плеоморфный, витиеватый) |
+ |
|
|
| LCIS (классический) |
|
|
+ |
| Атипичная гиперплазия |
|
|
+ |
|
 |
Член РООМ Валерий Витальевич Родионов ФГБУ «НМИЦ АКУШЕРСТВА, ГИНЕКОЛОГИИ И ПЕРИНАТОЛОГИИ ИМЕНИ АКАДЕМИКА В.И. КУЛАКОВА» МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РФ |
|
|
Дополнения в раздел 3.1.3 Стадии IIА (Т1N1М0), IIB (Т2N1М0, T3N0M0) и T3N1M0
«При конверсии cN1 в ycN0 после проведения неоадьювантной химиотерапии возможно выполнение таргетной аксиллярной лимфодиссекции, либо биопсии сигнальных лимфоузлов (при отсутствии маркировки метастатических лимфоузлов до начала неоадьювантной химиотерапии)» Уровень убедительности рекомендаций B (уровень достоверности доказательств 2) [Kuemmel S., Heil J, Rueland A., Seiberling C., Harrach H., et al. A Prospective, Multicenter Registry Study to Evaluate the Clinical Feasibility of Targeted Axillary Dissection (TAD) in Node-positive Breast Cancer Patients. Ann Surg. 2022 Nov 1;276(5):e553-e562. Kahler-Ribeiro- Fontana S, Pagan E, Magnoni F, Vicini E, Morigi C, Corso G, Intra M, Canegallo F, Ratini S, Leonardi MC, La Rocca E, Bagnardi V, Montagna E, Colleoni M, Viale G, Bottiglieri L, Grana CM, Biasuz JV, Veronesi P, Galimberti V. Long-term standard sentinel node biopsy after neoadjuvant treatment in breast cancer: a single institution ten-year follow-up. Eur J Surg Oncol. 2021 Apr;47(4):804-812; Banys-Paluchowski M; Del Rosario M, Perez C, Chavez Diaz M, Heidinger M et al. Oncological Outcomes Following Omission of Axillary Lymph Node Dissection in Node Positive Patients Downstaging To Node Negative with Neoadjuvant Chemotherapy: the OPBC-04/EUBREAST-06/OMA study. Cancer Res (2023) 83 Уровень убедительности рекомендаций B (уровень достоверности доказательств 2) [Kuemmel S., Heil J, Rueland A., Seiberling C., Harrach H., et al. A Prospective, Multicenter Registry Study to Evaluate the Clinical Feasibility of Targeted Axillary Dissection (TAD) in Node-positive Breast Cancer Patients. Ann Surg. 2022 Nov 1;276(5):e553-e562. Kahler-Ribeiro- Fontana S, Pagan E, Magnoni F, Vicini E, Morigi C, Corso G, Intra M, Canegallo F, Ratini S, Leonardi MC, La Rocca E, Bagnardi V, Montagna E, Colleoni M, Viale G, Bottiglieri L, Grana CM, Biasuz JV, Veronesi P, Galimberti V. Long-term standard sentinel node biopsy after neoadjuvant treatment in breast cancer: a single institution ten-year follow-up. Eur J Surg Oncol. 2021 Apr;47(4):804-812; Banys-Paluchowski M; Del Rosario M, Perez C, Chavez Diaz M, Heidinger M et al. Oncological Outcomes Following Omission of Axillary Lymph Node Dissection in Node Positive Patients Downstaging To Node Negative with Neoadjuvant Chemotherapy: the OPBC-04/EUBREAST-06/OMA study. Cancer Res (2023) 83 Комментарий: Аксиллярная хирургия включает следующие виды оперативных пособий: аксиллярная лимфодиссекция (АЛД) – удаление подмышечных лимфоузлов I и II уровня, иногда III уровня; биопсия сигнального (-ых) лимфоузла (-ов) (БСЛУ) – идентификация и удаление сигального (-ых) лимфоузла (-ов), используя в этих целях радиофармпрепарат (технеций -99), индоцианин зелёный или/и метиленовый синий; биопсия таргетных лимфоузлов (БТЛУ) – селективное удаление метастатического (-их) лимфоузла (-ов); промаркированных клипированием или установкой радиоактивных зёрен (йод-125) до начала неоадьювантной ХТ; таргетная аксиллярная диссекция (ТАД) – комбинация БСЛУ и БТЛУ. Целый ряд исследований продемонстрировал высокую частоту ложно- отрицательных результатов (8,4%-14,2%) при БСЛУ у пациенток с изначальным метастатическим поражением подмышечных лимфоузлов (Таблица 1) [Banys-Paluchowski M., Gasparri M.L., de Boniface J., Gentilini O. et al. Surgical Management of the Axilla in Clinically Node-Positive Breast Cancer Patients Converting to Clinical Node Negativity through Neoadjuvant Chemotherapy: Current Status, Knowledge Gaps, and Rationale for the EUBREAST-03 AXSANA Study. Cancers (Basel). 2021 Mar 29;13(7):1565.]. Комментарий: Аксиллярная хирургия включает следующие виды оперативных пособий: аксиллярная лимфодиссекция (АЛД) – удаление подмышечных лимфоузлов I и II уровня, иногда III уровня; биопсия сигнального (-ых) лимфоузла (-ов) (БСЛУ) – идентификация и удаление сигального (-ых) лимфоузла (-ов), используя в этих целях радиофармпрепарат (технеций -99), индоцианин зелёный или/и метиленовый синий; биопсия таргетных лимфоузлов (БТЛУ) – селективное удаление метастатического (-их) лимфоузла (-ов); промаркированных клипированием или установкой радиоактивных зёрен (йод-125) до начала неоадьювантной ХТ; таргетная аксиллярная диссекция (ТАД) – комбинация БСЛУ и БТЛУ. Целый ряд исследований продемонстрировал высокую частоту ложно- отрицательных результатов (8,4%-14,2%) при БСЛУ у пациенток с изначальным метастатическим поражением подмышечных лимфоузлов (Таблица 1) [Banys-Paluchowski M., Gasparri M.L., de Boniface J., Gentilini O. et al. Surgical Management of the Axilla in Clinically Node-Positive Breast Cancer Patients Converting to Clinical Node Negativity through Neoadjuvant Chemotherapy: Current Status, Knowledge Gaps, and Rationale for the EUBREAST-03 AXSANA Study. Cancers (Basel). 2021 Mar 29;13(7):1565.]. Таблица 1 – Исследования, посвященные изучению эффективности БСЛУ у пациенток РМЖ с изначальным метастатическим поражением подмышечных лимфоузлов после НАХТ Таблица 1 – Исследования, посвященные изучению эффективности БСЛУ у пациенток РМЖ с изначальным метастатическим поражением подмышечных лимфоузлов после НАХТ |
| Исследование |
Число пациенто в |
Частота идентификации сигнальных лимфоузлов |
Частота ложно- отрицательных результатов |
| SENTINA [Kuehn T., Bauerfeind I., Fehm T., Fleige B., Hausschild M., Helms G., Lebeau A., Liedtke C., von Minckwitz G., Nekljudova V., et al. Sentinel-lymph-node biopsy in patients with breast cancer before and after neoadjuvant chemotherapy (SENTINA): A prospective, multicentre cohort study. Lancet Oncol. 2013;14:609–618.] |
592 |
80,1% |
14,2% |
| SN FNAC [Boileau J.F., Poirier B., Basik M., Holloway C.M., et al. Sentinel node biopsy after neoadjuvant chemotherapy in biopsy-proven node-positive breast cancer: The SN FNAC study. J. Clin. Oncol. 2015;33:258–264.] |
153 |
87,6% |
8,4% |
| ACOSOG Z1071 [Boughey J.C., Suman V.J., Mittendorf E.A., Ahrendt G.M., et al. Sentinel lymph node surgery after neoadjuvant chemotherapy in patients with node-positive breast cancer: The ACOSOG Z1071 (Alliance) clinical trial. JAMA. 2013;310:1455– 1461.] |
649 |
92,9% |
12,6% |
| GANEA 2 [Classe J.M., Loaec C., Gimbergues P., Alran S., et al. Sentinel lymph node biopsy without axillary lymphadenectomy after neoadjuvant chemotherapy is accurate and safe for selected patients: The GANEA 2 study. Breast Cancer Res. Treat. 2019;173:343–352.] |
307 |
79,8% |
11,9% |
| Мета-анализ [Chehade H.E.H., Headon H., El Tokhy O., Heeney J., Kasem A., Mokbel K. Is sentinel lymph node biopsy a viable alternative to complete axillary dissection following neoadjuvant chemotherapy in women with node-positive breast cancer at diagnosis? An updated meta-analysis involving 3,398 patients. Am. J. Surg. 2016;212:969–981.] |
3398 |
91% |
13% |
|
В целях снижения частоты ложно-отрицательных результатов было предложено выполнение ТАД [Kuemmel S., Heil J, Rueland A., Seiberling C., Harrach H., et al. A Prospective, Multicenter Registry Study to Evaluate the Clinical Feasibility of Targeted Axillary Dissection (TAD) in Node-positive Breast Cancer Patients. Ann Surg. 2022 Nov 1;276(5):e553- e562.] и удаление более 2-х лимфоузлов [Boughey J.C., Suman V.J., Mittendorf E.A., et al. Sentinel Lymph Node Surgery after Neoadjuvant Chemotherapy in Patients With Node-Positive Breast Cancer: The American College of Surgeons Oncology Group (ACOSOG) Z1071 Clinical Trial. JAMA. 2013; 310(14): 1455–1461.]. Вместе с тем, при оценке эффективности аксиллярной хирургии у пациенток с метастатическим поражением подмышечных лимфоузлов после неоадьювантной ХТ идёт постепенное смещение парадигмы от частоты ложно-отрицательных результатов в сторону частоты регионарного рецидива. В связи с этим, результаты целого ряда исследований (таблица 2) демонстрируют онкологическую безопасность БСЛУ после неоадьювантной ХТ [Galimberti V., Kahler Ribeiro Fontana S, Vicini E., Morigi C., et. al. “This house believes that: Sentinel node biopsy alone is better than TAD after NACT for cN+ patients”. The Breast. 2023;67:21-25, Banys-Paluchowski M; Del Rosario M, Perez C, Chavez Diaz M, Heidinger M et al. Oncological Outcomes Following Omission of Axillary Lymph Node Dissection in Node Positive Patients Downstaging To Node Negative with Neoadjuvant Chemotherapy: the OPBC-04/EUBREAST-06/OMA study. Cancer Res (2023) 83 (5_Supplement): GS4-02]. Таблица 2 – Ретроспективные исследования, посвященные изучению онкологической безопасности БСЛУ у пациенток РМЖ с изначальным метастатическим поражением подмышечных лимфоузлов после НАХТ Таблица 2 – Ретроспективные исследования, посвященные изучению онкологической безопасности БСЛУ у пациенток РМЖ с изначальным метастатическим поражением подмышечных лимфоузлов после НАХТ |
| Исследование |
Число пациенто в |
Частота идентификации сигнальных лимфоузлов |
Частота ложно- отрицательных результатов |
Kahler Ribeiro Fontana S. [Kahler-Ribeiro-Fontana S, Pagan E, Magnoni F, Vicini E, et al. Long-term standard sentinel node biopsy after neoadjuvant treatment in breast cancer: a single institution ten-year follow-up. Eur J Surg Oncol. 2021 Apr;47(4):804-812]
Martelli G. [Martelli G., Barretta F., Miceli R., et al. Sentinel node biopsy alone or with axillary dissection in breast cancer patients after primary chemotherapy: long- term results of a prospective interventional study. Ann Surg. 2022;276(5):e544- e552] |
81 |
0% |
7 лет |
| Wong S.M. [ Wong S.M., Basik M., Florianova L., et al. Oncologic safety of sentinel lymph node biopsy alone after neoadjuvant chemotherapy for breast cancer Ann Surg Oncol. 2021;28(5):2621-2629] |
58 |
0% |
5 лет |
| Barrio A.V. [Barrio A.V., Montagna G., Mamtani A., et al. Nodal recurrence in patients with node-positive breast cancer treated with sentinel node biopsy alone after neoadjuvant chemotherapy-A rare event. JAMA Oncol. 2021;7(12): 1851-1855] |
234 |
1,6% |
3 года |
| Piltin M.A. [Piltin M.A., Hoskin T.L., Day C.N. et al. Oncologic Outcomes Sentinel Lymph Node Surgery After Neoadjuvant Chemotherapy for Node- Positive Breast Cancer. Ann Surg Oncol. 2020;27:4795– 4801] |
139 |
0,7% |
2 года |
|
 |
Член Правления РООМ д.м.н., проф. Горбунова Вера Андреевна ФГБУ "РОНЦ им. Н.Н. Блохина" Минздрава России, Москва |
|
|
Системное лечение больных МРМЖ со слиянием гена рецептора нейротрофической тирозинкиназы (NTRK).
Ларотректиниб 200 мг/сутки внутрь (в 2 приема) ежедневно Рекомендуется в качестве монотерапии для лечения пациентов с местно- распространенными и метастатическими солидными опухолями со слиянием гена рецептора нейротрофической тирозинкиназы (NTRK) В анализе по результатам 3 клинических исследований (NCT02576431, NCT02122913 и NCT02637687), частота объетивных ответов составила 69% (включая, более 20% полных ответов), медиана времени без прогрессирования– 29,4 месяца.
Обоснование.
1)Инструкция по медицинскому применению лекарственного препарата Витракви® ЛП- 008232-060622
 2)Efficacy of Larotrectinib in TRK Fusion-Positive Cancers in Adults and Children. Drilon A, Laetsch TW, Kummar S, DuBois SG, Lassen UN, Demetri GD, Nathenson M, Doebele RC, Farago AF, Pappo AS, Turpin B, Dowlati A, Brose MS, Mascarenhas L, Federman N, Berlin J, El-Deiry WS, Baik C, Deeken J, Boni V, Nagasubramanian R, Taylor M, Rudzinski ER, Meric-Bernstam F, Sohal DPS, Ma PC, Raez LE, Hechtman JF, Benayed R, Ladanyi M, Tuch BB, Ebata K, Cruickshank S, Ku NC, Cox MC, Hawkins DS, Hong DS, Hyman DM.N Engl J Med. 2018 Feb 22;378(8):731-739. doi: 10.1056/NEJMoa1714448. 3) Drilon A, et al. Poster presentation at ASCO 2022; Abstract 3100 3 Drilon A, et al. Poster presentation at ASCO 2022; Abstract 3100 2)Efficacy of Larotrectinib in TRK Fusion-Positive Cancers in Adults and Children. Drilon A, Laetsch TW, Kummar S, DuBois SG, Lassen UN, Demetri GD, Nathenson M, Doebele RC, Farago AF, Pappo AS, Turpin B, Dowlati A, Brose MS, Mascarenhas L, Federman N, Berlin J, El-Deiry WS, Baik C, Deeken J, Boni V, Nagasubramanian R, Taylor M, Rudzinski ER, Meric-Bernstam F, Sohal DPS, Ma PC, Raez LE, Hechtman JF, Benayed R, Ladanyi M, Tuch BB, Ebata K, Cruickshank S, Ku NC, Cox MC, Hawkins DS, Hong DS, Hyman DM.N Engl J Med. 2018 Feb 22;378(8):731-739. doi: 10.1056/NEJMoa1714448. 3) Drilon A, et al. Poster presentation at ASCO 2022; Abstract 3100 3 Drilon A, et al. Poster presentation at ASCO 2022; Abstract 3100 Drilon A, et al. Poster presentation at ASCO 2022; Abstract 3100 3 Drilon A, et al. Poster presentation at ASCO 2022; Abstract 3100 Drilon A, et al. Poster presentation at ASCO 2022; Abstract 3100 3 Drilon A, et al. Poster presentation at ASCO 2022; Abstract 3100 |
|
| В книгу «Золотой стандарт 2024» в раздел . РООМ БЛАГОДАРИТ АВТОРА |
 |
Член правления РООМ Оксана Петровна Трофимова д.м.н., ведущий научный сотрудник отделения радиотерапии ФГБУ «НМИЦ онкологии им.Н.Н.Блохина» Минздрава России; профессор кафедры онкологии и паллиативной медицины им. А.И.Савицкого РМА НПО Минздрава РФ |
|
|
3.3.4. Лучевая терапия в лечении больных местнораспространенным первично неоперабельный инвазивным раком молочной железы стадий IIIA (кроме T3N1M0), IIIB и IIIC, в т. ч. инфильтративно-отечная форма
Рекомендуется пациентам местнораспространенными формами РМЖ после РМЭ или органосохраняющих операций с целью оптимального локального контроля заболевания проводить ЛТ на мягкие ткани передней грудной стенки/молочную железу и все зоны лимфооттока вне зависимости от степени достигнутого лечебного патоморфоза в опухоли и ЛУ после неоадъювантной лекарственной терапии [54],[78],[181], [183], [208], [290].
 Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1) Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1)
Рекомендуется проводить лучевую терапию 5 раз в неделю СД 40,05 Гр за 15 фракций (РД 2,67 Гр) или СД 42,56 Гр за 16 фракций (РД 2,66 Гр). Режим фракционирования – 50 Гр за 25 фракций – выполняется в отдельных клинических ситуациях (системная красная волчанка, склеродермия; при анатомических особенностях, не позволяющих соблюсти дозо-объёмные ограничения), при возможности проведения только 2D лучевой терапии.
 Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2). Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Рекомендуется после органосберегающих операций подводить «буст» на ложе удаленной опухоли больным моложе 50 лет, при «положительном» или «близком» крае резекции, больным старше 50 лет при отсутствии полного лечебного патоморфоза в опухоли (особенно при ypN+), при исходной сТ3-4 [81].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
 Рекомендуется больным после мастэктомии подводить «буст» на послеоперационный рубец (при положительном или «близком» ( Рекомендуется больным после мастэктомии подводить «буст» на послеоперационный рубец (при положительном или «близком» (
 Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2). Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Рекомендуется подводить «буст» дозой 10–16 Гр за 4–8 фракций посредством ДЛТ, при наличии «положительного» или «близкого» краев резекции – дозой 12,5 Гр за 5 фракций или 16 Гр за 8 фракций.
 Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2). Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
 Рекомендуется в случае врастания опухоли в кожу молочной железы клинически или по данным морфологического исследования, при T4 послеоперационную ЛТ проводить с использованием тканеэквивалентных болюсов для создания адекватного дозового распределения в коже [54]. Рекомендуется в случае врастания опухоли в кожу молочной железы клинически или по данным морфологического исследования, при T4 послеоперационную ЛТ проводить с использованием тканеэквивалентных болюсов для создания адекватного дозового распределения в коже [54].
 Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3). Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3).
 Рекомендуется при наличии остаточных метастазов в над- или подключичных лимфоузлах провести ЛТ на надподключичную зону с локальным дополнительным облучением определяемых по данным УЗИ или КТ/МРТ исследований метастатических ЛУ. Рекомендуется при наличии остаточных метастазов в над- или подключичных лимфоузлах провести ЛТ на надподключичную зону с локальным дополнительным облучением определяемых по данным УЗИ или КТ/МРТ исследований метастатических ЛУ.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
 Комментарии: не рекомендуется проводить ЛТ зон лимфооттока отдельно без облучения прооперированной молочной железы или мягких тканей передней грудной стенки. Комментарии: не рекомендуется проводить ЛТ зон лимфооттока отдельно без облучения прооперированной молочной железы или мягких тканей передней грудной стенки.
 Рекомендуется проведение ЛТ на парастернальные ЛУ (с I по IV межреберье): Рекомендуется проведение ЛТ на парастернальные ЛУ (с I по IV межреберье):
- при наличии ≥4 пораженных подмышечных лимфатических узлов,
- при поражении 1–3 подмышечных лимфатических узлов при центральной/медиальной локализации опухоли у больных с G2-3 или нелюминальными подтипами,
- при поражении 1–3 подмышечных лимфатических узлов у пременопаузальных пациентов с G2-3 или нелюминальными подтипами,
- при гистологическом подтверждении поражения парастернальных л/узлов (pN1b, pN1c, pN2b, pN3b) или при наличии данных дополнительных методов исследования об их поражении (ПЭТ/КТ, УЗИ, КТ, МРТ). Дополнительный «буст» показан больным с наличием поражённых л/узлов, которые не были удалены хирургическим путем. Дополнительный «буст» показан больным с наличием поражённых л/узлов, которые не были удалены хирургическим путем. Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2). Рекомендуется курс послеоперационной ДЛТ при отсутствии показаний к адъювантной ХТ начать в срок 4–8 недель, но не позднее 12 недель от даты операции при условии полного заживления операционной раны [78], [208]. Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2). Рекомендуется курс послеоперационной ДЛТ при отсутствии показаний к адъювантной ХТ начать в срок 4–8 недель, но не позднее 12 недель от даты операции при условии полного заживления операционной раны [78], [208].
Комментарий: наличие лимфоцеле не является причиной задержки начала послеоперационной ЛТ (возможна периодическая эвакуация лимфы хирургами клиники).
 Рекомендуется при назначении адъювантной/постнеоадъювантной ХТ лучевую терапию начать через 3–4 недели после завершения последнего цикла ПХТ (за исключением адъювантной анти-HER2 таргетной терапии, терапии капецитабином, которые могут проводиться одновременно с ЛТ [81], [165]. Рекомендуется при назначении адъювантной/постнеоадъювантной ХТ лучевую терапию начать через 3–4 недели после завершения последнего цикла ПХТ (за исключением адъювантной анти-HER2 таргетной терапии, терапии капецитабином, которые могут проводиться одновременно с ЛТ [81], [165].
 Рекомендуется с целью оптимального локального контроля заболевания при неоперабельном/нерезектабельном опухолевом процессе после завершения лекарственного лечения или отказе пациентки от операции провести курс ДЛТ (предоперационный или радикальный). Рекомендуется с целью оптимального локального контроля заболевания при неоперабельном/нерезектабельном опухолевом процессе после завершения лекарственного лечения или отказе пациентки от операции провести курс ДЛТ (предоперационный или радикальный).
 Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2). Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2).
 Комментарий: опыт применения предоперационной ЛТ у больных неоперабельным РМЖ для улучшения резектабельности ограничен и недостаточно изучен в рандомизированных исследованиях. Разовые, суммарные дозы, объемы ЛТ варьируют в зависимости от конкретной клинической ситуации – от проведения ЛТ коротким курсом крупными фракциями с обезболивающей и даже гемостатической целью до радикального курса лучевой/химиолучевой терапии с включением в зону облучения молочной железы и зон лимфооттока и последовательным уменьшением объемов ЛТ. Комментарий: опыт применения предоперационной ЛТ у больных неоперабельным РМЖ для улучшения резектабельности ограничен и недостаточно изучен в рандомизированных исследованиях. Разовые, суммарные дозы, объемы ЛТ варьируют в зависимости от конкретной клинической ситуации – от проведения ЛТ коротким курсом крупными фракциями с обезболивающей и даже гемостатической целью до радикального курса лучевой/химиолучевой терапии с включением в зону облучения молочной железы и зон лимфооттока и последовательным уменьшением объемов ЛТ.
 Целесообразно начать ЛТ через 2–4 недели после завершения лекарственной терапии (после консилиума в составе врача-радиотерапевта, врача-хирурга и врача-онколога). Целесообразно начать ЛТ через 2–4 недели после завершения лекарственной терапии (после консилиума в составе врача-радиотерапевта, врача-хирурга и врача-онколога).
Рекомендуется с целью оптимального локального контроля над заболеванием проводить ЛТ на молочную железу и зоны лимфооттока на стороне поражения дозой 50 Гр за 25 фракций (5 раз в неделю). Режим умеренного гипофракционирования дозы (40,0–42,5 Гр в 15–16 фракциях) при местно-распространённом раке молочной железы не подтверждается доказательствами высокого уровня, но его можно использовать, основываясь на положительном опыте проспективных исследований после органосберегающих операций.
 Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2). Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Рекомендуется после подведения указанных доз ЛТ на молочную железу и зоны лимфооттока провести оценку эффекта лечения и повторное обсуждение тактики ведения пациентки на консилиуме в составе хирурга-онколога, химиотерапевта и радиотерапевта. При возможности выполнения хирургического лечения предпочтительна РМЭ.
Рекомендуется с целью оптимального локального контроля заболевания при невозможности выполнения операции или отказе пациентки от нее провести дополнительное облучение остаточных проявлений болезни (опухоль, ЛУ) в дозе 10–26 Гр. При выборе локальных полей облучения необходимо проведение УЗИ или КТ-исследования [54], [78], [81], [133].
 Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3). Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3).
3.3.5. Рецидивный рак молочной железы
 3.3.5.1. Лечение изолированных местных рецидивов 3.3.5.1. Лечение изолированных местных рецидивов
Тактика лечения больных определяется на мультидисциплинарном консилиуме с обсуждением всех потенциальных вариантов лечения для достижения оптимальных результатов.
Решение об использовании ЛТ для лечения локализованного рецидива должно учитывать любое проведенное ранее облучение области рецидива и риск развития поздних осложнений со стороны нормальных тканей (исходя из общей суммарной дозы проведенной и запланированной ЛТ).
Лучевая терапия в лечении локальных рецидивов в ипсилатеральной молочной железе
При первичном лечении – органосберегающая операция без послеоперационной ЛТ:
Рекомендуется выполнение «спасительной» мастэктомии. Послеоперационная ЛТ мягких тканей передней грудной стенки проводится в соответствии с показаниями по лечению больных после мастэктомии [106].
Рекомендуется выполнение резекции рецидивной опухоли и проведение послеоперационной ЛТ прооперированной молочной железы согласно рекомендациям по лечению больных РМЖ после органосберегающих операций.
Уровень убедительности рекомендаций В (уровень достоверности доказательств 2).
При первичном лечении – органосберегающая операция с послеоперационной ЛТ:
Рекомендуется выполнение мастэктомии.
Рекомендуется иссечение рецидивной опухоли с последующим облучением ложа удалённой опухоли для снижения риска второго локального рецидива с помощью 3D конформной ЛТ (с отступом от ложа опухоли до CTV 1,5 cм, CTV-PTV-1 см) РД 1,5 Гр суточная доза 3 Гр (интервал между фракциями не менее 6 часов), СД 45 Гр (категория рекомендации: 2b) [86] [87] или послеоперационной интерстициальной брахитерапии с дозами при брахитерапии HDR – 22–36 Гр (в 5–10 фракциях) брахитерапия PDR 45–50 Гр [88], [89], [90].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 3).
Комментарий: целесообразность о выполнении аксиллярной лимфодиссекции или БСЛУ зависит от объёма ранее проведенной лимфодиссекции и от конкретной клинической ситуации.
 3.3.5.2. Лучевая терапия в лечении больных с рецидивами РМЖ в области передней грудной стенки При первичном лечении – мастэктомия без послеоперационной ЛТ 3.3.5.2. Лучевая терапия в лечении больных с рецидивами РМЖ в области передней грудной стенки При первичном лечении – мастэктомия без послеоперационной ЛТ
Рекомендуется резекция рецидивной опухоли с последующим облучением всех мягких тканей передней грудной стенки РД 2 Гр СД 50–54 Гр. Режим умеренного гипофракционирования дозы (40–42,5 Гр в 15–16 фракциях) при лечении локальных рецидивов не подтверждается доказательствами высокого уровня, но его можно использовать, основываясь на положительном опыте проспективных исследований после органосберегающих операций.
Рассмотреть подведение «буста» на ложе иссечённого рецидива при «положительном» или «близком» крае резекции и невозможности выполнения ре-резекции дозой 10–16 Гр за 4–8 фракций [81].
 Уровень убедительности рекомендаций В (уровень достоверности доказательств 2). Уровень убедительности рекомендаций В (уровень достоверности доказательств 2).
Проведение ЛТ зон лимфооттока определяется в каждой конкретной клинической ситуации, зависит от локализации рецидивной опухоли, её размеров, наличия факторов неблагоприятного прогноза.
Комментарий: целесообразность выполнения аксиллярной лимфаденэктомии или БСЛУ зависит от объёма ранее проведенной лимфодиссекции и от конкретной клинической ситуации.
Комментарий: рекомендуется использовать тканеэквивалентный болюс для подведения адекватной кожной дозы.
 При первичном лечении – мастэктомия с послеоперационной ЛТ При первичном лечении – мастэктомия с послеоперационной ЛТ
Рекомендуется рассмотреть возможность иссечения рецидивной опухоли с последующей локальной дистанционной ЛТ или HDR брахитерапии с максимальной дозой 30 Гр [105].
Возможность повторного облучения ограничена, так как это может привести к серьёзным лучевым повреждениям мягких тканей (лучевая язва, некроз). Для лечения рецидивов больших размеров рекомендуется проводить паллиативную ЛТ. С паллиативной целью повторная ЛТ может проводиться с индивидуальным подбором дозы в зависимости от дозы проведенной ранее ЛТ (обычно 30–40 Гр стандартным фракционированием) с использованием полей небольших размеров [106].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 3).
Примечание: при наличии в радиотерапевтическом отделении оборудования возможно использование локальной гипертермии в качестве радиомодификатора [107].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 3).
 3.3.5.3. Лучевая терапия в лечении регионарных рецидивов 3.3.5.3. Лучевая терапия в лечении регионарных рецидивов
Рецидив в подмышечных лимфатических узлах:
Если ЛТ этой зоны ранее не проводилась – рекомендуется хирургическое удаление поражённого лимфатического узла с последующей ЛТ аксиллярной зоны в дозе 50 Гр за 25 фракций.
При невозможности удаления рецидива рекомендуется проведение ЛТ на аксиллярную область дозой 50–60 Гр за 25–30 фракций. Режим умеренного гипофракционирования дозы (РД 2,66–2,67 Гр 15–16–17 фракций) при лечении локальных рецидивов не подтверждается доказательствами высокого уровня, но можно рассмотреть его использование, основываясь на положительном опыте проспективных исследований по лучевой терапии зон регионарного лимфооттока у больных РМЖ [81].
Уровень убедительности рекомендаций В (уровень достоверности доказательств 2).
 В случае предшествующего облучения рекомендуется рассмотреть возможность паллиативного облучения небольшого объема с индивидуальным подбором дозы в зависимости от дозы ранее проведенной ЛТ (обычно 20–30 Гр) [81]. В случае предшествующего облучения рекомендуется рассмотреть возможность паллиативного облучения небольшого объема с индивидуальным подбором дозы в зависимости от дозы ранее проведенной ЛТ (обычно 20–30 Гр) [81].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 3).
Рецидив в надключичных лимфатических узлах:
Если ЛТ этой зоны ранее не проводилась – рекомендуется хирургическое удаление поражённого лимфатического узла с последующей ЛТ надподключичной области в дозе 50 Гр за 25 фракций. При невозможности удаления рецидива рекомендуется проведение ЛТ на всю надподключичную область в дозе 50 Гр за 25 фракций с «бустом» на остаточную опухоль СД 10–16 Гр за 4–8 фракций [81].
Уровень убедительности рекомендаций В (уровень достоверности доказательств 2)
В случае предшествующего облучения в паллиативных целях может быть проведена повторная ЛТ в дозе 30 Гр [81].
ОБОСНОВАНИЕ. Обоснование. Buchholz TA, Somerfield MR, Griggs JJ, et al. Margins for breast-conserving surgery with whole-breast irradiation in stage I and II invasive breast cancer: American Society of Clinical Oncology endorsement of the Society of Surgical Oncology/American Society for Radiation Oncology consensus guideline. J Clin Oncol. 2014 May 10;32(14):1502-6. doi: 10.1200/JCO.2014.55.1572. Moran MS, Schnitt SJ, Giuliano AE, et al. Society of Surgical Oncology-American Society for Radiation Oncology consensus guideline on margins for breast-conserving surgery with whole-breast irradiation in stages I and II invasive breast cancer. Int J Radiat Oncol Biol Phys. 2014 Mar 1;88(3):553-64. doi: 10.1016/j.ijrobp.2013.11.012. Meattini I, Becherini C, Boersma L, et al. European Society for Radiotherapy and Oncology Advisory Committee in Radiation Oncology Practice consensus recommendations on patient selection and dose and fractionation for external beam radiotherapy in early breast cancer. Lancet Oncol. 2022 Jan;23(1):e21-e31. doi: 10.1016/S1470-2045(21)00539-8. Jagsi R. Hypofractionated radiotherapy after mastectomy: a new frontier. Lancet Oncol. 2019 Mar;20(3):313-315. doi: 10.1016/S1470-2045(19)30062-2. Wang SL, Fang H, Song YW, et al. Hypofractionated versus conventional fractionated postmastectomy radiotherapy for patients with high-risk breast cancer: a randomised, non-inferiority, open-label, phase 3 trial. Lancet Oncol. 2019 Mar;20(3):352-360. doi: 10.1016/S1470-2045(18)30813-1. 5 Khan AJ, Poppe MM, Goyal S, et al. Hypofractionated Postmastectomy Radiation Therapy Is Safe and Effective: First Results From a Prospective Phase II Trial. J Clin Oncol. 2017 Jun 20;35(18):2037-2043. doi: 10.1200/JCO.2016.70.7158 |
 |
Член правления РООМ Оксана Петровна Трофимова д.м.н., ведущий научный сотрудник отделения радиотерапии ФГБУ «НМИЦ онкологии им.Н.Н.Блохина» Минздрава России; профессор кафедры онкологии и паллиативной медицины им. А.И.Савицкого РМА НПО Минздрава РФ |
|
|
3.3.3. Лучевая терапия в лечении больных РМЖ стадии IIА (Т1N1М0), IIВ (Т2N1М0, Т3N0М0), IIIA (Т3N1М0)
3.3.3.1. Показания к лучевой терапии у пациентов T1-3N1M0 и T3N0M0 без неоадъювантной лекарственной терапии после органосохраняющей операции:
 Рекомендуется проведение послеоперационной ДЛТ на прооперированную молочную железу для достижения оптимального локального контроля болезни [54], [81], [155], [191], [194]. Рекомендуется проведение послеоперационной ДЛТ на прооперированную молочную железу для достижения оптимального локального контроля болезни [54], [81], [155], [191], [194].
 Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1). Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
- всем больным моложе 50 лет;
- всем больным при наличии близкого (
- для больных старше 50 лет абсолютные показания к подведению «буста» – G3, трижды негативный подтип; относительные показания – размер опухоли >3 см, выраженный внутрипротоковый компонент, сосудистая инвазия [59], [81], [149], [195].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарий: ориентирами для определения ложа удаленной опухоли являются рентгеноконтрастные МРТ-совместимые навигационные клипсы (числом 4–5); послеоперационная серома; морфологические изменения в зоне бывшей опухоли, выявляемые на КТ-срезах; данные предоперационной КТ. При отсутствии ориентиров подведение «буста» не показано
Рекомендуется подводить «буст» дозой 10–16 Гр за 4–8 фракций посредством ДЛТ. При «положительном» крае резекции и невозможности выполнения ререзекции молочной железы рекомендуется подвести СД 12,5 Гр за 5 фракций/16 Гр за 8 фракций [54],[816],[82]
Уровень убедительности рекомендаций А (уровень достоверности доказательств 2).
Комментарий: наличие клеток в фасциальном крае резекции без клинических признаков распространения за пределы фасции следует рассматривать как R0 (при условии, что фасция грудной мышцы была резецирована). В этой клинической ситуации подведение «буста» не показано.
3.3.3.2. Показания к лучевой терапии зон лимфооттока у пациентов сT1-3N1M0 и T3N0M0 без неоадъювантной лекарственной терапии после органосохраняющих операций: Рекомендуется больным с сT1-3N1M0 при рN1 после аксиллярной лимфодиссекции проведение ЛТ на зоны лимфооттока [82], [133]. Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1). Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарий: целесообразно рассмотреть возможность отказа от ЛТ у больных с низким риском рецидива опухоли: наличие рТ1, положительный статус по рецепторам эстрогенов (РЭ+), степень злокачественности G1, HER2-отрицательный подтип опухоли (при наличии как минимум 3 критериев) [133].
Рекомендуется больным с сT1-3N1M0 при рN1(sn) после БСЛУ проведение ЛТ всех уровней лимфооттока (частота метастазов в неудалённых не сторожевых ЛУ составляет 27–38 %). Достаточно облучить I–II уровни аксиллярных ЛУ при наличии более низкого риска рецидива: люминальные подтипы опухоли, статус pT1, однофокальность, поражение только 1 из нескольких СЛУ, проведенная эффективная системная терапия, постменопаузальный возраст пациента.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарий: при наличии 1–2 макрометастазов без экстракапсулярной инвазии, наличии R0, без проведения неоадъювантной ХТ (в соответствии с критериями ACOSOG Z011) без последующей аксиллярной лимфодиссекции, локализации опухоли в наружных квадрантах, степени злокачественности G1-2, люминальном подтипе опухоли, постменопаузальном возрасте достаточно облучения I–II уровней аксиллярных ЛУ. Верхней границей объема облучения в этом случае является граница, проходящая на 1 см ниже головки плечевой кости [67], [124], [155],[157],[158].
Рекомендуется больным с сT3N0M0 при pN0-Nmic после аксиллярной лимфодиссекции или БСЛУ рассмотреть вопрос облучения всех уровней лимфооттока в случае наличия факторов неблагоприятного прогноза (опухоли центральной/медиальной локализации, лимфоваскулярная инвазия, G3, наличие отрицательного статуса по рецепторам эстрогенов (РЭ-), трижды негативный подтип, наличие сосудистой инвазии, удаление 1 СЛУ, низкая ожидаемая эффективность системной терапии или ее отсутствие, молодой (пременопаузальный) возраст).
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Рекомендуется больным с сT3N1M0 при pN1 после аксиллярной лимфодиссекции или БСЛУ проводить ЛТ всех уровней лимфооттока.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарий: не рекомендуется проводить ЛТ зон лимфооттока отдельно без облучения прооперированной молочной железы.
 3.3.3.3. Показания к лучевой терапии у пациентов T1-3N1M0 и T3N0M0 после неоадъювантной лекарственной терапии и после органосохраняющей операции: 3.3.3.3. Показания к лучевой терапии у пациентов T1-3N1M0 и T3N0M0 после неоадъювантной лекарственной терапии и после органосохраняющей операции:
Рекомендуется проведение послеоперационной ДЛТ на оперированную молочную железу для достижения оптимального локального контроля болезни [54], [81], [155], [191], [194].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
Рекомендуется проведение дополнительного облучения ложа удаленной опухоли («буст») с целью снижения частоты локального рецидива (без влияния на общую выживаемость):
- всем больным моложе 50 лет;
- всем больным при наличии близкого ( - больным старше 50 лет при G3 или при отсутствии полного лечебного патоморфоза в опухоли (особенно при ypN+) [81], [133].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1). Комментарий: ориентирами для определения ложа удаленной опухоли являются рентгеноконтрастные, МРТ-совместимые навигационные клипсы (числом 4–5); послеоперационная серома; морфологические изменения в зоне бывшей опухоли, выявляемые на КТ-срезах; данные предоперационной КТ. При отсутствии ориентиров подведение «буста» не показано.
Рекомендуется подводить «буст» дозой 10–16 Гр за 4–8 фракций посредством ДЛТ. При «положительном» крае резекции и невозможности выполнения ререзекции молочной железы рекомендуется подвести СД 12,5 Гр за 5 фракций/16 Гр за 8 фракций [59], [81], [149], [195].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарий: наличие клеток в фасциальном крае резекции без клинических признаков распространения за пределы фасции следует рассматривать как R0 (при условии, что фасция грудной мышцы была резецирована). В этой клинической ситуации подведение «буста» не показано.
 3.3.3.4. Показания к лучевой терапии зон лимфооттока у пациентов с T1-3N1M0 и T3N0M0 после неоадъювантной лекарственной терапии и после органосберегающей операции: 3.3.3.4. Показания к лучевой терапии зон лимфооттока у пациентов с T1-3N1M0 и T3N0M0 после неоадъювантной лекарственной терапии и после органосберегающей операции:
в настоящее время рекомендации по ЛТ зон лимфооттока окончательно не определены, показания к ее проведению определяются с учетом конкретной клинической ситуации [54], [82].
Рекомендуется при сT1-3N1M0 и ypN0 рассмотреть проведение ЛТ на зоны лимфооттока, показания к ее проведению определяются с учетом конкретной клинической ситуации (например, у больных с нелюминальными подтипами опухоли и др.)
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Рекомендуется при сT1-3N1M0 и ypN+ ЛТ на зоны лимфооттока
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Рекомендуется при сT3N0-1M0 и ypN0-N+ ЛТ на зоны лимфооттока
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Не рекомендуется проводить ЛТ зон лимфооттока без облучения молочной железы
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
 3.3.3.5. Показания к лучевой терапии мягких тканей передней грудной стенки и зон лимфооттока у пациентов с сT1-3N1M0 и T3N0M0 без неоадъювантной лекарственной терапии после мастэктомии с реконструкцией/без реконструкции молочной железы: 3.3.3.5. Показания к лучевой терапии мягких тканей передней грудной стенки и зон лимфооттока у пациентов с сT1-3N1M0 и T3N0M0 без неоадъювантной лекарственной терапии после мастэктомии с реконструкцией/без реконструкции молочной железы:
Рекомендуется пациентам с сT1-3N1M0 при pN1 после подмышечной лимфодиссекции проводить ЛТ мягких тканей передней грудной стенки и всех уровней лимфооттока.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарий: пациентам с благоприятными факторами прогноза ЛТ мягких тканей передней грудной стенки и уровней лимфооттока не показана (статус рТ1, наличие положительного статуса по рецепторам эстрогенов (ER+), G1, HER2-отрицательный подтип (при наличии как минимум 3 критериев).
Рекомендуется пациентам с сT1-3N1M0 при pN1 после БСЛУ проводить ЛТ мягких тканей передней грудной стенки и всех уровней лимфооттока.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарий: при наличии благоприятных прогностических факторов (1–2 макрометастаза без экстракапсулярной инвазии, R0, без проведения неоадъювантной ХТ (в соответствии с критериями ACOSOG Z011), без последующей аксиллярной лимфодиссекции, при локализации опухоли в наружных квадрантов, степени злокачественности G1-2, люминальном подтипе опухоли, постменопаузальном возрасте) достаточно облучения I–II уровней лимфооттока.
Рекомендуется пациентам с сT3N0M0 при pN0-Nmic проводить ЛТ мягких тканей передней грудной стенки. У пациентов с наличием факторов неблагоприятного прогноза (опухоли центральной/медиальной локализации, лимфоваскулярная инвазия, G3, наличие отрицательного статуса по рецепторам эстрогенов (РЭ-), трижды негативный подтип, наличие сосудистой инвазии, удаление только 1 СЛУ, низкая ожидаемая эффективность системной терапии или ее отсутствие, молодой (пременопаузальный) возраст) – рассмотреть вопрос облучения всех уровней лимфооттока.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Рекомендуется пациентам с сT3N1MO при pN1 после аксиллярной лимфодиссекции или БСЛУ проводить ЛТ всех уровней лимфооттока.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарий: не рекомендуется проводить ЛТ зон лимфооттока отдельно без облучения прооперированной молочной железы или мягких тканей передней грудной стенки. ЛТ, проведенная вместо подмышечной лимфодиссекции, эквивалентна хирургическому вмешательству по показателям общей и безрецидивной выживаемости.
 3.3.3.6. Показания к лучевой терапии мягких тканей передней грудной стенки и зон лимфооттока у пациентов T1-3N1M0 и T3N0M0 после неоадъювантной лекарственной терапии и после мастэктомии с/без реконструкции молочной железы: 3.3.3.6. Показания к лучевой терапии мягких тканей передней грудной стенки и зон лимфооттока у пациентов T1-3N1M0 и T3N0M0 после неоадъювантной лекарственной терапии и после мастэктомии с/без реконструкции молочной железы:
В настоящее время рекомендации по ЛТ зон лимфооттока окончательно не определены, показания к ее проведению определяются с учетом конкретной клинической ситуации:
Рекомендуется при сT1-3N1M0 и ypN0 рассмотреть проведение ЛТ на переднюю грудную стенку и зоны лимфооттока у больных с наличием факторов неблагоприятного прогноза (например, с нелюминальными подтипами опухоли и др.).
Рекомендуется при сT1-3N1M0 и ypN+ проведение ЛТ на переднюю грудную стенку и зоны лимфооттока.
Рекомендуется при сT3N0-1M0 и ypN0-N+ проведение ЛТ на переднюю грудную стенку и зоны лимфооттока [81], [133], [180].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Рекомендуется при «положительном» или «близком» крае резекции и невозможности выполнения ререзекции у пациентов после мастэктомии проводить ЛТ на мягкие ткани передней грудной стенки с «бустом» на послеоперационный рубец 12,5 Гр за 5 фракций/16 Гр за 8 фракций [59], [81], [149], [195].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарий: наличие клеток в фасциальном крае резекции без клинических признаков распространения за пределы фасции следует рассматривать как R0 (при условии, что фасция грудной мышцы была резецирована). В этой клинической ситуации подведение «буста» не показано [81].
Не рекомендуется проводить ЛТ зон лимфооттока без облучения молочной железы/мягких тканей передней грудной стенки.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарий: при проведении одномоментной реконструкции молочной железы экспандером или имплантом показания к ЛТ грудной стенки и реконструированной молочной железы соответствуют вышеизложенным рекомендациям.
Комментарий: адекватный объём лимфодиссекции – >6 удалённых лимфоузлов; при неадекватно проведенной лимфодиссекции целесообразно проведение ЛТ всех зон лимфооттока [81].
 3.3.3.7. Показания к проведению лучевой терапии парастернальных лимфатических узлов 3.3.3.7. Показания к проведению лучевой терапии парастернальных лимфатических узлов
Рекомендуется рассмотреть целесообразность проведения ЛТ на парастернальные лимфатические узлы (с I по IV межреберье):
- при pN0 у больных с центральной или медиальной локализацией опухоли в пременопаузальном возрасте с G2-3 и при нелюминальных подтипах;
- при наличии ≥4 пораженных подмышечных ЛУ,
- при поражении 1–3 подмышечных лимфатических узлов при центральной/ медиальной локализации опухоли у больных с G2-3 или нелюминальными подтипами,
- при поражении 1–3 подмышечных лимфатических узлов у пременопаузальных пациентов с G2-3 или нелюминальными подтипами,
- при гистологическом подтверждении поражения парастернальных л/узлов (pN1b, pN1c, pN2b, pN3b) или при наличии данных дополнительных методов исследования об их поражении (ПЭТ/КТ, УЗИ, КТ, МРТ).
Дополнительный «буст» на парастернальные ЛУ показан больным с наличием пораженных л/узлов, которые не были удалены хирургическим путем.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Не рекомендована ЛТ парастернальной области как рутинная. Ценность планового облучения парастернальных лимфатических узлов выяснена не полностью и остается спорной; врач-радиотерапевт всегда должен учитывать риски облучения легких и сердца.
Клинические проявления рецидива в парастернальных лимфатических узлах очень редки (
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
 3.3.3.8. Режимы фракционирования лучевой терапии на молочную железу/мягкие ткани передней грудной стенки ± зоны лимфооттока пациентам с РМЖ с неоадъювантной химиотерапией/без неоадъювантной химиотерапии: 3.3.3.8. Режимы фракционирования лучевой терапии на молочную железу/мягкие ткани передней грудной стенки ± зоны лимфооттока пациентам с РМЖ с неоадъювантной химиотерапией/без неоадъювантной химиотерапии:
Рекомендуется во всех перечисленных клинических ситуациях проводить ЛТ:
- при облучении молочной железы 5 раз в неделю суммарной дозой 40,05 Гр за 15 фракций (РД 2,67 Гр) или 42,56 Гр за 16 фракций (РД 2,66 Гр);
- при облучении мягких тканей передней грудной стенки и зон лимфооттока в радиотерапевтических отделениях, оснащенных линейными ускорителями электронов с многолепестковыми коллиматорами диафрагмы, с возможностью объемного планирования для проведения 3D-конформной лучевой терапии проводить лучевую терапию 5 раз в неделю суммарной дозой 40,05 Гр за 15 фракций (РД 2,67 Гр) или 42,56 Гр за 16 фракций (РД 2,66 Гр). Режим фракционирования – 46–50 Гр за 23–25 фракций – рекомендовано выполнять в отдельных клинических ситуациях (системная красная волчанка, склеродермия; при анатомических особенностях, но позволяющих соблюсти дозо-объёмные ограничения) и при возможности проводить только 2D лучевую терапию [54], [81], [82], [325].
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1).
Обоснование.
Buchholz TA, Somerfield MR, Griggs JJ, et al. Margins for breast-conserving surgery with whole-breast irradiation in stage I and II invasive breast cancer: American Society of Clinical Oncology endorsement of the Society of Surgical Oncology/American Society for Radiation Oncology consensus guideline. J Clin Oncol. 2014 May 10;32(14):1502-6. doi: 10.1200/JCO.2014.55.1572.
Moran MS, Schnitt SJ, Giuliano AE, et al. Society of Surgical Oncology-American Society for Radiation Oncology consensus guideline on margins for breast-conserving surgery with whole-breast irradiation in stages I and II invasive breast cancer. Int J Radiat Oncol Biol Phys. 2014 Mar 1;88(3):553-64. doi: 10.1016/j.ijrobp.2013.11.012. Meattini I, Becherini C, Boersma L, et al. European Society for Radiotherapy and Oncology Advisory Committee in Radiation Oncology Practice consensus recommendations on patient selection and dose and fractionation for external beam radiotherapy in early breast cancer. Lancet Oncol. 2022 Jan;23(1):e21-e31. doi: 10.1016/S1470-2045(21)00539-8. Jagsi R. Hypofractionated radiotherapy after mastectomy: a new frontier. Lancet Oncol. 2019 Mar;20(3):313-315. doi: 10.1016/S1470-2045(19)30062-2.
Wang SL, Fang H, Song YW, et al. Hypofractionated versus conventional fractionated postmastectomy radiotherapy for patients with high-risk breast cancer: a randomised, non-inferiority, open-label, phase 3 trial. Lancet Oncol. 2019 Mar;20(3):352-360. doi: 10.1016/S1470-2045(18)30813-1.
5 Khan AJ, Poppe MM, Goyal S, et al. Hypofractionated Postmastectomy Radiation Therapy Is Safe and Effective: First Results From a Prospective Phase II Trial. J Clin Oncol. 2017 Jun 20;35(18):2037-2043. doi: 10.1200/JCO.2016.70.7158 |
 |
Член правления РООМ Оксана Петровна Трофимова д.м.н., ведущий научный сотрудник отделения радиотерапии ФГБУ «НМИЦ онкологии им.Н.Н.Блохина» Минздрава России; профессор кафедры онкологии и паллиативной медицины им. А.И.Савицкого РМА НПО Минздрава РФ |
|
|
3.3.2.11. Сроки начала послеоперационной лучевой терапии определяются в соответствии со следующими принципами:
Рекомендуется во всех перечисленных клинических ситуациях начать курс послеоперационной ДЛТ при отсутствии показаний к адъювантной химиотерапии в срок 4–8 недель, но не более 12 недель от даты операции при условии полного заживления операционной раны [81], [172], [194].
 Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1). Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарий: наличие лимфоцеле не является причиной задержки начала послеоперационной ЛТ (возможна периодическая эвакуация лимфы)
 Рекомендуется при назначении адъювантной ХТ начать ЛТ через 3–4 недели после завершения последнего цикла ХТ (за исключением адъювантной анти-НЕR-2 таргетной терапии, терапии капецитабином, которые могут проводиться одновременно с лучевой терапией [81], [165]. Рекомендуется при назначении адъювантной ХТ начать ЛТ через 3–4 недели после завершения последнего цикла ХТ (за исключением адъювантной анти-НЕR-2 таргетной терапии, терапии капецитабином, которые могут проводиться одновременно с лучевой терапией [81], [165].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2)

3.3.2.12. Последовательность проведения лучевой терапии и лекарственной терапии в адъювантном периоде проведение послеоперационной ЛТ возможно одновременно с применением трастузумаба/пертузумаба (с осторожностью – у больных с облучением парастернальных л/узлов); трастузумаба эмтанзина; тамоксифена (возможно последовательное и одновременное применение), ингибиторов ароматазы; капецитабина (следует рассмотреть возможность снижения дозы капецитабина во время курса ЛТ).
Прием ингибиторов CDK 4/6, олапариба целесообразно проводить после окончания лучевой терапии [81], [166], [167], [168], [169], [238], [239], [240], [264].
 ОБОСНОВАНИЕ Polgár C, Kahán Z, Ivanov O, et al. Radiotherapy of Breast Cancer-Professional Guideline 1st Central-Eastern European Professional Consensus Statement on Breast Cancer. Pathol Oncol Res. 2022 Jun 23;28:1610378. doi: 10.3389/pore.2022.1610378. Meattini I, Becherini C, Boersma L, et al. European Society for Radiotherapy and Oncology Advisory Committee in Radiation Oncology Practice consensus recommendations on patient selection and dose and fractionation for external beam radiotherapy in early breast cancer. Lancet Oncol. 2022 Jan;23(1):e21-e31. doi: 10.1016/S1470-2045(21)00539-8. ОБОСНОВАНИЕ Polgár C, Kahán Z, Ivanov O, et al. Radiotherapy of Breast Cancer-Professional Guideline 1st Central-Eastern European Professional Consensus Statement on Breast Cancer. Pathol Oncol Res. 2022 Jun 23;28:1610378. doi: 10.3389/pore.2022.1610378. Meattini I, Becherini C, Boersma L, et al. European Society for Radiotherapy and Oncology Advisory Committee in Radiation Oncology Practice consensus recommendations on patient selection and dose and fractionation for external beam radiotherapy in early breast cancer. Lancet Oncol. 2022 Jan;23(1):e21-e31. doi: 10.1016/S1470-2045(21)00539-8. Adamowicz K, Marczewska M, Jassem J. Combining systemic therapies with radiation in breast cancer. Cancer Treat Rev. 2009 Aug;35(5):409-16. doi: 10.1016/j.ctrv.2009.04.012. Varga Z, Cserháti A, Kelemen G, et al. Role of systemic therapy in the development of lung sequelae after conformal radiotherapy in breast cancer patients. Int J Radiat Oncol Biol Phys. 2011 Jul 15;80(4):1109-16. doi: 10.1016/j.ijrobp.2010.03.044. Adamowicz K, Marczewska M, Jassem J. Combining systemic therapies with radiation in breast cancer. Cancer Treat Rev. 2009 Aug;35(5):409-16. doi: 10.1016/j.ctrv.2009.04.012. Varga Z, Cserháti A, Kelemen G, et al. Role of systemic therapy in the development of lung sequelae after conformal radiotherapy in breast cancer patients. Int J Radiat Oncol Biol Phys. 2011 Jul 15;80(4):1109-16. doi: 10.1016/j.ijrobp.2010.03.044. Marinko T, Dolenc J, Bilban-Jakopin C. Cardiotoxicity of concomitant radiotherapy and trastuzumab for early breast cancer. Radiol Oncol. 2014 Apr 25;48(2):105-12. doi: 10.2478/raon-2013-0040. Marinko T, Dolenc J, Bilban-Jakopin C. Cardiotoxicity of concomitant radiotherapy and trastuzumab for early breast cancer. Radiol Oncol. 2014 Apr 25;48(2):105-12. doi: 10.2478/raon-2013-0040. Azria D, Gourgou S, Sozzi WJ, et al. Concomitant use of tamoxifen with radiotherapy enhances subcutaneous breast fibrosis in hypersensitive patients. Br J Cancer. 2004 Oct 4;91(7):1251-60. doi: 10.1038/sj.bjc.6602146. Azria D, Gourgou S, Sozzi WJ, et al. Concomitant use of tamoxifen with radiotherapy enhances subcutaneous breast fibrosis in hypersensitive patients. Br J Cancer. 2004 Oct 4;91(7):1251-60. doi: 10.1038/sj.bjc.6602146. |
| |
 |
Член правления РООМ к. м.н. Асель Галимовна Кудайбергенова ФГБУ НМИЦ онкологии им.Н.Н.Петрова, Санкт-Петербург |
|
|
 |
Генеральный директор РООМ к.м.н., Руслан Маликович Палтуев ФГБУ "НМИЦ Онкологии им. Н.Н. Петрова" МЗ РФ |
|
|
Рекомендации по тестированию HER2 (методами qPCR, РАМ 50 NGS
Тестирование на HER2 и NGS
Высокая корреляция между генным статусом HER2 и уровнем мРНК HER2 хорошо документирована . Для анализа мРНК HER2 применяется несколько методик, в том числе количественные, такие как количественная ПЦР в реальном времени (qPCR). Однако, эти методы не нашли широкого применения в клинической практике и в настоящее время не признаны в качестве альтернативных методов оценки HER2 статуса в диагностической практике.
Тесты на экспрессию генов, такие как Oncotype Dx и Prosigna, в настоящее время используются в некоторых случаях для оценки ER-позитивного/ HER2-статуса. Oncotype Dx позволяет определить уровень мРНК HER2, а Prosigna - позволяет определить внутренний подтип, например, HER2-обогащенный. Следует отметить, что существует лишь незначительная корреляция между внутренним подтипом, установленным с помощью профилирования экспрессии генов, и клиническим уровнем HER2-реакции; до трети HER2-обогащенных опухолей являются HER2-негативными при использовании общепринятых методик и примерно треть HER2-положительных опухолей классифицируются как не-HER2 обогащенные . Тем не менее, в случае несоответствия результатов клинического теста экспрессии генов с результатами клинического исследования, необходимо пересмотреть результаты анализа на HER2 (IHC+/-ISH), и если первоначальный HER2-статус был установлен при трепанобиопсии, следует рассмотреть возможность проведения повторного HER2-тестирования.
HER2-тестирование должно быть проведено на образце для эксцизии (в идеале на том же блоке, который был представлен для геномного тестирования). Несмотря на корреляцию между молекулярным классом, обогащенным HER2, и ответом на терапию анти-HER2 , окончательный результат определения HER2 в дискордантных случаях должен основываться на утвержденных в настоящее время анализах (IHC+/-ISH) после валидации результатов. Результаты геномных анализов не должны использоваться для определения HER2-статуса опухоли как положительного или отрицательного для клинического лечения.
Методы NGS, такие как секвенирование всего генома, находят все большее применение в клинической практике. Методы NGS могут помочь выявить ERBB2-активирующие мутации [74] и увеличение количества копий HER2, а также составить список генов, предположительно коррелирующих с ответом или резистентностью к терапии HER2 [75]. Однако их использование в клинической практике для определения статуса HER2 статуса еще предстоит оценить; надежность NGS-анализа для выявления HER2-статуса, критерии определения HER2-позитивности и доказательства в пользу использования NGS в качестве предиктора ответа на анти-HER2 терапию по сравнению с существующими утвержденными анализами. В опухолях, в которых результаты HER2 NGS не совпадают с результатами одобренных анализов (IHC и/или ISH), HER2-статус определяется в соответствии с результатами одобренных анализов.
Рекомендации
► Статус HER2 должен определяться только для клинического ведения с использованием одобренных в настоящее время анализов, т.е. IHC+/-ISH.
► Дополнительные анализы, которые, например, позволяют определить уровень мРНК HER2 или NGS, могут быть ценными для обеспечения качества диагностических результатов.
Обоснование.
Обновленные рекомендации Великобритании по оценке HER2 при раке молочной железы
Emad A Rakha , Puay Hoon Tan, Cecily Quinn, Elena Provenzano, Abeer M Shaaban, Rahul Deb , Grace Callagy, Jane Starcaynski, Andrew H S Lee, Ian O Ellis, Sarah E Pinder
Палтуев Р.М., Алексахина С.Н., Артемьева А.С., Байчоров Э.А., Бахарев С.Ю., Божок А.А., Васин В.А., Владимиров В.И., Волынщикова О.А., Воронцов А.Ю., Гайсина Е.А., Гофман А.А., Имянитов Е.Н., Клименко В.В., Комяхов А.В., Константинова М.М., Копп М.В., Кудайбергенова А.Г., Лалак И.А., Матевосян Д.Л., Муджири Н.М., Полтарева О.В., Севрюкова О.И., Семиглазов В.Ф., Семиглазова Т.Ю., Урезкова М.М., Чурилова Л.А. Предиктивная 100-генная шкала. Анализ диагностической эффективности при метастатическом раке молочной железы. Опухоли женской репродуктивной системы. 2023;19(1):69-81.
https://doi.org/10.17650/1994-4098-2023-19-1-69-81
NanoString nCounter® Approach in Breast Cancer: A Comparative Analysis with Quantitative Real-Time Polymerase Chain Reaction, In Situ Hybridization, and Immunohistochemistry. Hyeon J, et al. J Breast Cancer. 2017 |
 |
Член правления РООМ Оксана Петровна Трофимова д.м.н., ведущий научный сотрудник отделения радиотерапии ФГБУ «НМИЦ онкологии им.Н.Н.Блохина» Минздрава России; профессор кафедры онкологии и паллиативной медицины им. А.И.Савицкого РМА НПО Минздрава РФ |
|
|
Дополнения.
3.3.2. Лучевая терапия в лечении больных РМЖ стадии I (Т1N0М0) и IIА (Т2N0М0)
3.3.2.1. Показания к лучевой терапии у пациентов РМЖ сT1N0M0, сT2N0M0 после органосохраняющей операции без неоадъювантной лекарственной терапии
Рекомендуется проведение послеоперационной ДЛТ на оперированную молочную железу для достижения оптимального локального контроля болезни.
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
Рекомендуется проведение дополнительного облучения ложа удаленной опухоли («буст») с целью снижения частоты локального рецидива (без влияния на общую выживаемость):
- всем больным моложе 50 лет;
- всем больным при наличии «положительного» или «близкого» (
- для больных старше 50 лет абсолютные показания к подведению «буста» – G3, трижды негативный подтип; относительные – размер опухоли >3 см, наличие сосудистой инвазии, выраженный внутрипротоковый компонент [59], [81], [149], [195].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарий: ориентирами для определения ложа удаленной опухоли являются рентгеноконтрастные, МРТ-совместимые навигационные клипсы (числом 4–5); послеоперационная серома; морфологические изменения в зоне бывшей опухоли, выявляемые на КТ-срезах; данные предоперационной КТ. При отсутствии ориентиров подведение «буста» не показано.
Рекомендуется подводить «буст» дозой 10–16 Гр за 4–8 фракций посредством ДЛТ. При «положительном» крае резекции и невозможности выполнения ререзекции молочной железы рекомендуется подвести СД 12,5 Гр за 5 фракций/16 Гр за 8 фракций
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарий: наличие клеток в фасциальном крае резекции без клинических признаков распространения за пределы фасции следует рассматривать как R0 (при условии, что фасция грудной мышцы была резецирована). В этой клинической ситуации подведение «буста» не показано. [81].
3.3.2.2. Показания к лучевой терапии зон лимфооттока у пациентов с РМЖ cT1-2N0M0 без неоадъювантной лекарственной терапии после органосохраняющей операции с лимфодиссекцией
Не рекомендуется проводить ЛТ зон лимфооттока при pN0-N1mic.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Рекомендуется рассмотреть целесообразность облучения всех уровней лимфооттока при наличии факторов риска развития рецидива: центральная/медиальная локализация опухоли или статус рТ2 и хотя бы один из перечисленных признаков: лимфоваскулярная инвазия, степень злокачественности G3, наличие отрицательного статуса по рецепторам эстрогенов (РЭ-), больные с
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1). 3.3.2.3. Показания к лучевой терапии зон лимфооттока у пациентов с РМЖ cT1-2N0M0 без неоадъювантной лекарственной терапии после органосохраняющей операции с БСЛУ:
Не рекомендуется проводить ЛТ зон лимфооттока при pN0-N1mic.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Рекомендуется рассмотреть целесообразность облучения всех уровней лимфооттока у пациентов с наличием нескольких неблагоприятных факторов: степень злокачественности G3, статус >pT1, мультифокальный характер роста опухоли, наличие сосудистой инвазии, удаление 1 СЛУ, наличие критерия Nmic (>0,2 и ≤2,0 мм), трижды негативный подтип, молодой (пременопаузальный) возраст Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Рекомендуется у больным с низким риском развития локального рецидива рассмотреть возможность проведения ускоренного частичного облучения молочной железы (APBI) при соблюдении всех перечисленных критериев:
- 3.3.возраст пациенток ≥50 лет;
- наличие одного опухолевого узла размерами ≤3 см, имеющего строение не долькового инвазивного рака;
- отсутствие поражённых лимфатических узлов – рNо;
- «негативные» края резекции шириной ≥2 мм;
- отсутствие признаков лимфоваскулярной инвазии, выраженного внутрипротокового компонента;
- отсутствие мутаций BRCA 1,2;
- люминальные НER2-негативные подтипы
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2). Рекомендуется проводить APBI с использованием 3D конформной ЛТ, брахитерапии. Режимы проведения APBI 3D конформной ЛТ: 2,67 Гр, 15 фракций; 5,2 Гр, 5 ежедневных фракций; 30 Гр за 5 фракций (РД 6 Гр, лечение через день, технология IMRT). При проведении высокодозной брахитерапии (HDR) возможны режимы: 4,3 Гр, 7 фракций; 4 Гр, 8 фракций или 3,4 Гр (2 фракции в день с перерывом не менее 6 ч), 10 фракций
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Не рекомендуется проведение APBI с использованием интраоперационной ЛТ электронами или низкоэнергетическими фотонами в рутинной практике.
Комментарий: ориентирами для определения ложа удаленной опухоли являются рентгеноконтрастные, МРТ-совместимые навигационные клипсы (числом 4–5); послеоперационная серома; морфологические изменения в зоне бывшей опухоли, выявляемые на КТ-срезах; данные предоперационной КТ. При отсутствии ориентиров проведение APBI не показано.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Рекомендуется у больных с низким риском развития локального рецидива рассмотреть отказ от послеоперационного облучения молочной железы при наличии всех перечисленных критериев (возраст ≥70 лет, pT1N0, ER+ статус, HER2 отрицательный подтип опухоли, «отрицательные» края резекции, планируемая адъювантная эндокринная терапия) [54], [81], [155].
Комментарий: ЛТ может быть исключена из плана лечения после разъяснения пациентке повышенного риска развития локального рецидива при отсутствии этапа ЛТ и после подписания больной информированного согласия.
Уровень убедительности рекомендаций В (уровень достоверности доказательств 2). 3.3.2.4. Показания к лучевой терапии у пациентов РМЖ cT1-2N0M0 после неоадъювантной лекарственной терапии и органосохраняющей операции
Рекомендуется всем пациенткам проведение адъювантной ЛТ на прооперированную молочную железу для снижения риска местного рецидива. Дозы и режимы фракционирования см. ниже
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
Рекомендуется проведение дополнительного облучения ложа удаленной опухоли («буст») с целью снижения частоты локального рецидива (без влияния на общую выживаемость):
- всем больным моложе 50 лет;
- всем больным при наличии близкого (
- больным старше 50 лет при степени злокачественности G3 или при отсутствии полного лечебного патоморфоза в опухоли (особенно при ypN+) [59], [81], [149], [195].
Комментарий: ориентирами для определения ложа удаленной опухоли являются рентгеноконтрастные, МРТ-совместимые навигационные клипсы (числом 4–5); послеоперационная серома; морфологические изменения в зоне бывшей опухоли, выявляемые на КТ-срезах; данные предоперационной КТ. При отсутствии ориентиров подведение «буста» не показано.
Рекомендуется «буст» проводить дозой 10–16 Гр за 4–8 фракций посредством ДЛТ. При «положительном» крае резекции и невозможности выполнения ререзекции молочной железы рекомендуется подвести СД 12,5 Гр за 5 фракций/16 Гр за 8 фракций
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарий: наличие клеток в фасциальном крае резекции без клинических признаков распространения за пределы фасции следует рассматривать как R0 (при условии, что фасция грудной мышцы была резецирована). В этой клинической ситуации подведение «буста» не показано [81].
3.3.2.5. Показания к лучевой терапии зон лимфооттока у пациентов с РМЖ cT1-2N0M0 с неоадъювантной лекарственной терапией после органосохраняющей операции с лимфодиссекцией или БСЛУ при ypN0-Nmic:
Не рекомендуется проводить ЛТ зон лимфооттока.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарий: в настоящее время рекомендации по ЛТ зон лимфооттока после неоадъювантной системной терапии и хирургического лечения не определены, показания к ее проведению определяются с учетом конкретной клинической ситуации (возможно рассмотреть ее проведение при наличии нескольких факторов неблагоприятного прогноза).
3.3.2.6. Показания к лучевой терапии у пациентов с РМЖ cT1-2N0M0 после мастэктомии с реконструкцией/без реконструкции молочной железы без неоадъювантной лекарственной терапии с аксиллярной лимфодиссекцией
Не рекомендуется проводить ЛТ после радикальной мастэктомии при отрицательных краях резекции и pNo-1mic
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарий: рекомендуется рассмотреть проведение ЛТ на мягкие ткани передней грудной стенки при «положительных» или близких краях резекции (
Комментарий: при проведении одномоментной реконструкции молочной железы экспандером или имплантом показания к ЛТ грудной стенки и реконструированной молочной железы соответствуют вышеизложенным рекомендациям.
Комментарий: наличие клеток в фасциальном крае резекции без клинических признаков распространения за пределы фасции следует рассматривать как R0 (при условии, что фасция грудной мышцы была резецирована). В этой клинической ситуации подведение «буста» не показано [81].
Не рекомендуется проводить ЛТ зон лимфооттока без облучения молочной железы/мягких тканей передней грудной стенки.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарий: при проведении одномоментной реконструкции молочной железы экспандером или имплантом показания к ЛТ грудной стенки и реконструированной молочной железы соответствуют вышеизложенным рекомендациям.
Комментарий: адекватный объём лимфодиссекции – >6 удалённых лимфоузлов; при неадекватно проведенной лимфодиссекции целесообразно проведение ЛТ всех зон лимфооттока [81
3.3.2.7. Показания к лучевой терапии у пациентов с РМЖ cT1-2N0M0 после мастэктомии с реконструкцией/без реконструкции молочной железы без неоадъювантной лекарственной терапии с БСЛУ:
Не рекомендуется проводить ЛТ после мастэктомии с/без реконструкции молочной железы при отрицательных краях резекции и pNo-1mic.
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2).
Рекомендуется рассмотреть проведение ЛТ на мягкие ткани передней грудной стенки при «положительных» или близких краях резекции (pT1, мультифокальность, наличие сосудистой инвазии, удаление 1 СЛУ, наличие микрометастаза в лимфатическом узле (>0,2 и ≤2,0 мм) без последующей лимфаденэктомии, при низкой ожидаемой эффективности системной терапии или ее отсутствии, трижды негативный подтип, молодой (пременопаузальный) возраст [54], [81], [155].
Рекомендуется при наличии «положительного» или «близкого» (
Комментарий: наличие клеток в фасциальном крае резекции без клинических признаков распространения за пределы фасции следует рассматривать как R0 (при условии, что фасция грудной мышцы была резецирована). В этой клинической ситуации подведение «буста» не показано [81].
3.3.2.8. Показания к лучевой терапии у пациентов РМЖ cT1-2N0M0 после неоадъювантной лекарственной терапии и мастэктомии с реконструкцией/без реконструкции молочной железы с аксиллярной лимфодиссекцией или БСЛУ при ypN0-Nmic:
Не рекомендуется проводить ЛТ на мягкие ткани грудной стенки и зоны лимфооттока.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Рекомендуется проведение ЛТ на мягкие ткани передней грудной стенки при «положительном» или «близком» крае резекции (Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Рекомендуется при наличии «положительного» или «близкого» (
Комментарий: наличие клеток в фасциальном крае резекции без клинических признаков распространения за пределы фасции следует рассматривать как R0 (при условии, что фасция грудной мышцы была резецирована). В этой клинической ситуации подведение «буста» не показано [81].
Комментарий: в настоящее время рекомендации по ЛТ мягких тканей передней грудной стенки и зон лимфооттока после неоадъювантной системной терапии и хирургического лечения не определены, показания к ее проведению определяются с учетом конкретной клинической ситуации (возможно рассмотреть ее проведение при наличии нескольких факторов неблагоприятного прогноза).
Не рекомендуется проводить ЛТ зон лимфооттока без облучения молочной железы/мягких тканей передней грудной стенки.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Обоснование
Whelan T.J., et al. LUMINA: A prospective trial omitting radiotherapy (RT) following breast conserving surgery (BCS) in T1N0 luminal A breast cancer (BC). J Clin Oncol 2022;40(suppl.17):LBA501. DOI: 10.1200/JCO.2022.40.17_suppl.LBA501
Peng G., Zhou Zh., Can J.M., et al. Can a subgroup at high risk for LRR be identified from T1-2 breast cancer with negative lymph nodes after mastectomy? A meta-analysis. Biosci Rep. 2019;39(9):BSR20181853.
Wang J., Tang Y., Jing H., et al. Risk stratification for prediction of locoregional recurrence in patients with pathologic T1-2N0 breast cancer after mastectomy BMC Cancer. 2020;20(1):1132. DOI: 10.1186/s12885-020-07594-7.
Montero A., Ciérvide R., García-Aranda M., et al. Postmastectomy radiation therapy in early breast cancer: Utility or futility? Crit Rev Oncol Hematol 2020;147:102887. DOI: 10.1016/j.critrevonc.2020.102887. Epub 2020 Jan 30.
Аdamovicz K., Marczewska M., Jassem J. Combining Systemic Therapies with Radiation in Breast Cancer. Cancer Treat Rev 2009; 35:409–16. DOI: 10.1016/j.ctrv.2009.04.012
Дополнения.
3.3.1. Лучевая терапия в лечении больных РМЖ стадия 0 (ТisN0М0), рак in situ
Дольковый рак in situ (Lobular Carcinoma In situ, LCIS): послеоперационная ЛТ не проводится.
Протоковый рак in situ (Ductal Carcinoma in Situ, DCIS): всем пациентам после органосохраняющей операции рекомендуется проведение адъювантной ЛТ для снижения риска местного рецидива.
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1).
Больным молодого возраста (
Больным DCIS c низким риском развития локального рецидива при наличии всех перечисленных признаков – возраст старше 50 лет, размеры опухоли
Уровень убедительности рекомендаций В (уровень достоверности доказательств 2).
Лучевая терапия зон лимфооттока больным pTisN0M0 не показана. Больным с DCIS после выполнения мастэктомии ЛТ не показана. Больным с болезнью Педжета соска после органосберегающих операций показана ЛТ на молочную железу.
Комментарий: если у пациентки, подвергшейся оперативному вмешательству по поводу предполагаемого DCIS, обнаруживается инвазивный РМЖ, то последующее лечение должно проводиться в соответствии со стадией, гистологическими и молекулярными характеристиками инвазивной опухоли. Обоснование
1.Breast Cancer, Version 3.2022, NCCN Clinical Practice Guidelines in Oncology, Journal of the National Comprehensive Cancer Network Journal of the National Comprehensive Cancer Network, 7 May 2022. 2.Polgár C, Kahán Z, Ivanov O, et al. Radiotherapy of Breast Cancer-Professional Guideline 1st Central-Eastern European Professional Consensus Statement on Breast Cancer. Pathol Oncol Res. 2022 Jun 23;28:1610378. doi: 10.3389/pore.2022.1610378.
3.Masinghe SP, Faluyi OO, Kerr GR, Kunkler IH. Breast radiotherapy for occult breast cancer with axillary nodal metastases--does it reduce the local recurrence rate and increase overall survival? Clin Oncol (R Coll Radiol). 2011 Mar;23(2):95-100. doi: 10.1016/j.clon.2010.10.001.
4.Boutrus RR, Khair S, Abdelazim Y, Nasr S, Ibraheem MH, Farahat A, El Sebaie M. Phyllodes tumors of the breast: Adjuvant radiation therapy revisited. Breast. 2021 Aug;58:1-5. doi: 10.1016/j.breast.2021.03.013.
5.Cante D, Paolini M, Piva C, et al. Hypofractionation and Concomitant Boost in Ductal Carcinoma In Situ (DCIS): Analysis of a Prospective Case Series with Long-Term Follow-Up. Life (Basel). 2022 Jun 14;12(6):889. doi: 10.3390/life12060889
3.3 Лучевая терапия
Рекомендуется для снижения частоты локорегионарных рецидивов проводить современную 3D конформную дистанционную ЛТ на линейных ускорителях электронов с многолепестковыми коллиматорами диафрагмы фотонами 6 или 18 МэВ, электронами различных энергий или на протонном ускорителе с использованием протонного пучка 70−230 МэВ.
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
При отсутствии линейных ускорителей электронов дистанционную ЛТ рекомендуется проводить на дистанционных гамма-терапевтических аппаратах.
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2a).
Рекомендуется при проведении ЛТ использовать специальные фиксирующие приспособления для повышения точности и воспроизводимости укладок больных – позиборды, подголовники, подставки под колени.
Рекомендуется выполнять объемное планирование с оконтуриванием легочной, сердечной тканей, контралатеральной молочной железы для минимизации дозовой нагрузки на них. Дозу в заданной мишени рассчитывают согласно рекомендациям Международной комиссии по радиационным единицам и измерениям МКРЕ-50, 62 и 83, дозы в нормальных тканях рекомендуется ограничивать согласно данным QUANTEC, но без ущерба для покрытия планируемого лечебного объема Целесообразно регулярно проводить верификацию укладок пациенток и лечебных программ на аппарате для проведения ЛТ. Рекомендуется пользоваться руководствами по оконтуриванию.
Рекомендуется проводить ЛТ не чаще 5 дней в неделю.
Рекомендуется при левосторонней локализации опухоли или при небольшом объёме лёгких при наличии технического оснащения проводить ЛТ с задержкой дыхания на глубоком вдохе для снижения дозовой нагрузки на сердечную и/или лёгочную ткань
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1). Обоснование.
. ICRU Report 83 // Journal of the ICRU. 2010. Vol. 10, № 1. Breast Cancer Atlas for Radiation Therapy Planning: Consensus Definition RTOG.
Marks LB, Yorke ED, Jackson A, et al. Use of normal tissue complication probability models in the clinic. Int J Radiat Oncol Biol Phys. 2010 Mar 1;76(3 Suppl):S10-9. doi: 10.1016/j.ijrobp.2009.07.175.
Артемова Н.А., Минайло И.И., Страх А.Г. Предлучевая подготовка с использованием объемного планирования: инструкция по применению. Минск, 2009.
Offersen BV, Boersma LJ, Kirkove C, et al. ESTRO consensus guideline on target volume delineation for elective radiation therapy of early stage breast cancer, version 1.1. Radiother Oncol. 2016 Jan;118(1):205-8. doi: 10.1016/j.radonc.2015.12.027.
Kaidar-Person O, Vrou Offersen B, Hol S, et al. ESTRO ACROP consensus guideline for target volume delineation in the setting of postmastectomy radiation therapy after implant-based immediate reconstruction for early stage breast cancer. Radiother Oncol. 2019 Aug;137:159-166. doi: 10.1016/j.radonc.2019.04.010.
Strnad V, Hannoun-Levi JM, Guinot JL, et al. Recommendations from GEC ESTRO Breast Cancer Working Group (I): Target definition and target delineation for accelerated or boost Partial Breast Irradiation using multicatheter interstitial brachytherapy after breast conserving closed cavity surgery. Radiother Oncol. 2015 Jun;115(3):342-8. doi: 10.1016/j.radonc.2015.06.010.
Utehina O. Healthy tissue sparing postoperative radiotherapy for treatment of early stage breast cancer.Riga, Summary of the doctoral thesis. 2009:32.
Giraud P, Djadi-Prat J, Morelle M, et al. Contribution of respiratory gating techniques for optimization of breast cancer radiotherapy. Cancer Invest. 2012 May;30(4):323-30. doi: 10.3109/07357907.2012.657818.
Kunheri B, Kotne S, Nair SS, Makuny D. A dosimetric analysis of cardiac dose with or without active breath coordinator moderate deep inspiratory breath hold in left sided breast cancer radiotherapy. J Cancer Res Ther. 2017 Jan-Mar;13(1):56-61. doi: 10.4103/jcrt.JCRT_1414_16.
Тимошкина Е.В. Диссертация на соискание ученой степени кандидата медицинских наук «Разработка рациональной тактики лучевой терапии при различных вариантах реконструктивно-пластической операции у больных раком молочной железы». Москва, 2020.
Stuart KE, Houssami N, Taylor R, et al. Long-term outcomes of ductal carcinoma in situ of the breast: a systematic review, meta-analysis and meta-regression analysis. BMC Cancer. 2015 Nov 10;15:890. doi: 10.1186/s12885-015-1904-7.
Budach W, Krug D, Kuhn et al. AGO e.V. in der DGGG e.V. sowie in der DKG e.V. Guidelines Breast Version 2022.1 E.
Thorsen LB, Offersen BV, Danø H, J. DBCG-IMN: A Population-Based Cohort Study on the Effect of Internal Mammary Node Irradiation in Early Node-Positive Breast Cancer. J Clin Oncol. 2016 Feb 1;34(4):314-20. doi: 10.1200/JCO.2015.63.6456. Epub 2015 Nov 23.
Sávolt Á, Péley G, Polgár C, et al. Eight-year follow up result of the OTOASOR trial: The Optimal Treatment Of the Axilla - Surgery Or Radiotherapy after positive sentinel lymph node biopsy in early-stage breast cancer: A randomized, single centre, phase III, non-inferiority trial. Eur J Surg Oncol. 2017 Apr;43(4):672-679. doi: 10.1016/j.ejso.2016.12.011.
Zhu L, Jin L, Li S, Chen K, Jia W, Shan Q, Walter S, Song E, Su F. Which nomogram is best for predicting non-sentinel lymph node metastasis in breast cancer patients? A meta-analysis. Breast Cancer Res Treat. 2013 Feb;137(3):783-95. doi: 10.1007/s10549-012-2360-6. Epub 2013 Jan 5. Erratum in: Breast Cancer Res Treat. 2013 May;139(1):295-300.
3.3.2.9. Показания к проведению лучевой терапии парастернальных лимфатических узлов
Рекомендуется рассмотреть целесообразность проведения ЛТ на парастернальные лимфатические узлы (с I по IV межреберье):
- при pN0 у больных с центральной или медиальной локализацией опухоли в пременопаузальном возрасте с G2-3 и при нелюминальных подтипах;
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Не рекомендована ЛТ парастернальной области как рутинная. Ценность планового облучения парастернальных лимфатических узлов выяснена не полностью и остается спорной; врач-радиотерапевт всегда должен учитывать риски облучения легких и сердца.
Клинические проявления рецидива в парастернальных лимфатических узлах очень редки (
3.3.2.10. Режимы фракционирования лучевой терапии на молочную железу/мягкие ткани передней грудной стенки +/- зоны лимфооттока пациентам РМЖ с неоадъювантной лекарственной терапией/без неоадъювантной лекарственной терапии:
Рекомендуется во всех перечисленных клинических ситуациях проводить ЛТ
- при облучении молочной железы 5 раз в неделю суммарной дозой 40,05 Гр за 15 фракций (РД 2,67 Гр) или 42,56 Гр за 16 фракций (РД 2,66 Гр);
- при облучении мягких тканей передней грудной стенки и зон лимфооттока в радиотерапевтических отделениях, оснащенных линейными ускорителями электронов с многолепестковыми коллиматорами диафрагмы, с возможностью объемного планирования для проведения 3D-конформной лучевой терапии проводить ЛТ 5 раз в неделю суммарной дозой 40,05 Гр за 15 фракций (РД 2,67 Гр) или 42,56 Гр за 16 фракций (РД 2,66 Гр). Режим фракционирования – 46–50 Гр за 23–25 фракций – рекомендуется выполнять в отдельных клинических ситуациях (системная красная волчанка, склеродермия; при анатомических особенностях, не позволяющих соблюсти дозо-объёмные ограничения) и при возможности проводить только 2D лучевую терапию [54], [81], [82],[133].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Не рекомендуется проводить ЛТ зон лимфооттока без облучения молочной железы/мягких тканей передней грудной стенки.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Обоснование
Meattini I, Becherini C, Boersma L, et al. European Society for Radiotherapy and Oncology Advisory Committee in Radiation Oncology Practice consensus recommendations on patient selection and dose and fractionation for external beam radiotherapy in early breast cancer. Lancet Oncol. 2022 Jan;23(1):e21-e31. doi: 10.1016/S1470-2045(21)00539-8. Jagsi R. Hypofractionated radiotherapy after mastectomy: a new frontier. Lancet Oncol. 2019 Mar;20(3):313-315. doi: 10.1016/S1470-2045(19)30062-2. Budach W, Matuschek C, Bölke E, et al. DEGRO practical guidelines for radiotherapy of breast cancer V: Therapy for locally advanced and inflammatory breast cancer, as well as local therapy in cases with synchronous distant metastases. Strahlenther Onkol. 2015 Aug;191(8):623-33. doi: 10.1007/s00066-015-0843-1. Epub 2015 May 12. Erratum in: Strahlenther Onkol. 2015 Aug;191(8):634. Wenz, Frederick [corrected to Wenz, Frederik]. |
|